Ключевые слова: тяжелые металлы, растворы солей, сорбция, овощи, грибы, токсичность.
Поступая в микроорганизмы, растения, грибы, организмы животных, человека тяжелые металлы влияют на процессы обмена веществ и, по достижении определенных концентраций в клеточной жидкости, тканях, оказывают на живые организмы токсическое воздействие [1,2]. Среди них можно выделить не участвующие в обмене веществ тяжелые металлы, токсичные в разной степени для живых веществ. Из этой группы тяжелых металлов выделяют свинец, ртуть, кадмий, которые являются суперэкотоксикантами [1,2]. Они являются химическими стрессорами для биосферы, так как эти металлы и их соединения чрезвычайно токсичны для живых существ даже в очень малых количествах [1,2]. Среди тяжелых металлов условно выделяют микроэлементы: железо, медь, цинк, молибден. Эти химические элементы в небольших количествах являются необходимыми для поддержания нормального обмена веществ и жизнедеятельности, но их избыток в тканях организмов, также приводит к токсическому воздействию.
Основным путем поступления тяжелых металлов в организмы живых существ является потребление содержащих тяжелые металлы воды, пищи, питательных веществ [3]. В случае их высокого содержания в продуктах питания, потребляемой воды выведение тяжелых металлов из организма за счет естественной регуляции не обеспечит их безопасный для здоровья уровень содержания в тканях организма и, в конечном итоге, приведет к накоплению тяжелых металлов в тканях организма. Если не будут своевременно приняты необходимые меры, то с высокой степенью вероятности токсическое воздействие накапливающихся в организме тяжелых металлов вызовет развитие хронических заболеваний. На почве отравления тяжелыми металлами возможно развитие опасных болезней с высоким риском летального исхода (онкология, почечная недостаточность и ряд других) [3].
Характерным историческим примером этого является использование ацетата свинца или, как его называли, «свинцового сахара» в качестве подсластителя и консерванта пищи, компонента лекарственных средств, что приводило к массовым отравлениям свинцом жителей древнего Рима [4,5]. Содержание свинца в костях человеческих останков, датируемых этим историческим периодом, было существенно выше, чем у более древних захоронений людей в этой местности [6].
Хроническое отравление свинцом, особенно жителей городов, в ту эпоху было очень широко распространено. Оно получило название «сатурнизм». Постоянное употребление продуктов питания и напитков, использование косметики и лекарственных средств, содержащих соединения свинца, было причиной массового ухудшения здоровья людей в течение многих поколений, что стало одним из факторов, приведших к упадку древнего Рима [4, 5].
Но в средние века «свинцовый сахар» все равно употреблялся в пищу жителями европейских государств, хотя вред здоровью людей от «свинцового сахара» к тому времени стал очевиден. Из исторических хроник известно, что данная проблема стояла очень остро в европейских государствах. В качестве исторического примера борьбы с употреблением в пищу «свинцового сахара» в Европе можно привести запрет на употребление ацетата свинца Папой Римским Александром VI в 1498 году специально посвященной этому буллой — особым распоряжением для священнослужителей и верующих. В России ацетат свинца использовался не так широко, как в Европе, в основном, в качестве консерванта и подсластителя дешевых сортов вин, в лекарственных средствах. Помимо отравлений соединениями свинца, в древнем мире, в средневековой Европе обыденным явлением были отравления людей соединениями меди. Наиболее токсичным из них был ацетат меди или, как его называли, «ярь-медянка» [7].
Он образуется при длительном контакте медной посуды с уксусом, возникающим при сбраживании продуктов в этой посуде. Отравления, как правило, происходили при попадании «ярь-медянки» в пищу, напитки. В качестве примера массового отравления людей тяжелыми металлами, имевшего место сравнительно недавно, можно привести потребление морепродуктов с высоким содержанием ртути, выловленных в акватории залива Минамата, что привело в 1956–57 гг. к массовому отравлению местного населения соединениями ртути [8].
Биосфера нашей планеты постоянно загрязняется токсичными солями и соединениями тяжелых металлов, поступающих из техногенных и природных источников [1,2,3], которые поступают в атмосферу, природные воды, а затем в почвы, на которых растут растения, грибы, употребляемые в пищу. Содержание тяжелых металлов в растениях, грибах, произрастающих на почвах, загрязненных тяжелыми металлами, будет возрастать по мере их роста и развития. Если растениями, выросшими на таких почвах, будут питаться сельскохозяйственные животные, то весьма вероятно, что содержание тяжелых металлов в тканях их организмов тоже будет высоким. Потребление продуктов питания с повышенным содержанием тяжелых металлов человека приводит к увеличению их содержания в тканях организма [1].
Однако поступление тяжелых металлов в растения, грибы возможно не только в процессе их роста и развития, но и при подготовке для приготовления в пищу: при промывке от загрязнений, вымачивании измельченных продуктов питания в воде, содержащей катионы тяжелых металлов в концентрациях, которые существенно превышают их предельно допустимые концентрации (ПДК), установленные всемирной организацией здравоохранения (ВОЗ), законодательством Российской Федерации. Актуальным представляется проведение исследований взаимодействия катионов солей тяжелых металлов, растворенных в воде, с продуктами питания человека, которые могут сорбировать эти катионы из водных сред. Такими продуктами питания — «природными сорбентами» являются овощи, грибы, злаки, фрукты.
По мнению исследователей [9,10,11,12] наилучшими способностями к сорбции катионов тяжелых металлов обладают овощи и грибы. Механизм сорбции катионов тяжелых металлов на клетчатке овощей имеет сложный характер. Помимо сорбции на клетчатке (целлюлозе), содержание которой в соцветиях свежей цветной капусты может составлять до 2,0 % массовых [13], возможно образование устойчивых химических соединений тяжелых металлов с различными органическими веществами, содержащимися в клетках (различные полисахариды и другие).
По данным [14], плодовые тела высших грибов могут содержать от 8 % до 43 % по массе поли-N-ацетил-D-глюкозо-2-амина (хитина), являющегося сорбентом. Этот биополимер содержит несколько функциональных групп: гидроксильные, карбонильные, амино-, ацетиламидные группы и кислородные мостики. Механизм сорбции ионов тяжелых металлов хитином сложным образом зависит от условий, он может включать комплексообразование, ионный обмен и поверхностную адсорбцию.
Однако исследователи [9,12] склоняются к тому, что чаще всего преобладает хелатное комплексообразование, то есть хемосорбция. Благодаря своим уникальным свойствам хитин сорбирует ионы всех тяжелых металлов. Следует отметить, что из-за сложных многофакторных механизмов сорбции не разработана теория, которая могла бы точно предсказывать характеристики процесса сорбции катионов тяжелых металлов из водных растворов «природными сорбентами». Тем не менее, возможно экспериментально определить удельную сорбцию катионов тяжелых из водных растворов их солей «природными сорбентами».
Целью работы является экспериментальное определение удельной сорбции продуктов питания — «природных сорбентов», выбранных в качестве модельных: плодовых тел белых грибов (лат. Bolétus edúlis), шампиньонов (лат. Agaricus), соцветий цветной капусты (лат. Brassica oleracea Botrytis Group) катионов меди, свинца из водных растворов их солей. В этих же условиях было проведено определение удельной сорбции катионов этих металлов активированным углем, применяемым в медицине в качестве сорбента при пищевых отравлениях, что позволило сравнить «природные сорбенты» с активированным углем по величине удельной сорбции.
Для определения удельной сорбции был выбран метод, основанный на измерениях содержания катионов тяжелых металлов в водных растворах после приготовления, то есть до контакта этих растворов с сорбентами, и после их выдержки в контакте с «природными сорбентами» при постоянной температуре в течение определенного времени. Условно принимается, что концентрация катионов в растворе будет снижаться только за счет сорбции на «природном сорбенте». Раствор после выдержки отделяется от частиц «природного сорбента» фильтрованием. Затем проводится определение содержания катиона в растворе после выдержки с сорбентом. Исходя из разницы начальной и конечной концентраций, объема раствора определяется масса (количество вещества) сорбированного катиона. Зная массу сорбента и массу сорбированного катиона, можно определить удельную сорбцию в мг (ммоль) катиона на грамм «природного сорбента».
Выбор модельных «природных сорбентов» был обусловлен широкой доступностью данных продуктов питания, а также возможностью их измельчения без образования гелей, которые препятствовали бы фильтрации раствора соли тяжелых металлов после выдержки при контакте с сорбентом, а также большого объема жидкостей (соков), образующихся при измельчении. В качестве солей тяжелых металлов выбраны производимые в промышленных масштабах широко используемые соли: сульфат меди (II), ацетат свинца (II).
Необходимо отметить, что медь относится к микроэлементам, а свинец к токсичным для человеческого организма тяжелым металлам. Сульфат меди используется в разных отраслях промышленности, а также в сельском хозяйстве в качестве фунгицидного средства. Ацетат свинца применяется в химической промышленности. Нельзя исключить вероятность загрязнения данными солями природных вод при нарушении экологических требований: при сбросе их концентрированных растворов в природные водоемы, поступлении в почву, а затем в грунтовые воды.
Проблема использования загрязненной воды для питья и приготовления пищи является очень острой для стран Центральной Африки, Юго-Восточной Азии и ряда других регионов, испытывающих дефицит чистой пресной воды. В отсутствии чистой пресной воды население вынуждено использовать воду из существующих природных источников, даже если она загрязнена промышленными стоками, содержащими соли тяжелых металлов и другие токсичные вещества. Эти природные воды без предварительной очистки от тяжелых металлов вынуждено будут использоваться населением для промывки продуктов питания от загрязнений, в том числе измельченных овощей, грибов, фруктов, злаков, их вымачивания перед приготовлением.
С целью минимизации влияния на сорбцию катионов примесей других веществ для приготовления модельных растворов были использованы реактивы содержащие небольшое количество примесей: сульфат меди ГОСТ 4165–78квалификации ч. д.а. (содержание основного вещества не менее 99,5 % масс.), ацетат свинца ГОСТ 1027–67 квалификации ч. (содержание основного вещества не менее 98 % масс.). Для приготовления модельных растворов солей использовалась дистиллированная вода с малым содержанием примесей: общее солесодержание в воде, определенное по её электропроводности, было менее 1 мг/л. В качестве концентрации катионов тяжелых металлов для модельных растворов, имитирующих сильно загрязненную природную воду, была выбрана концентрация 100 мг/л.
Такое содержание катиона меди приблизительно в 95 раз, а свинца в 3833 раза больше ПДК, установленных для питьевой воды СанПиН 2.1.4.1074–01. Для приготовления раствора с концентрацией близкой к 100 мг/л брались расчетные навески солей, необходимые для приготовления 1 л их раствора. Растворы готовились в стеклянных мерных колбах объемом 1 л растворением навесок солей в дистиллированной воде при комнатной температуре. Точно получить концентрацию 100 мг/л в растворе путем взятия и растворения навески соли очень сложно, так как содержание основного вещества в использованных реактивах меньше 100 %, а также сульфат меди и ацетат свинца поглощают пары воды из воздушной атмосферы в процессе хранения. Фактическую концентрацию катионов в полученных растворах определяли по результатам анализа их проб после приготовления.
Цветная капуста и шампиньоны была куплены в магазине сети SPAR, плодовые тела белых грибов были собраны в сентябре 2023 г в смешанном лесу вдали от автомобильной трассы, высушены и хранились в герметичной таре. При подготовке к эксперименту соцветия цветной капусты были промыты дистиллированной водой и просушены на воздухе при комнатной температуре, а затем измельчены на кусочки размерами до 2–3 мм. Шампиньоны были промыты дистиллированной водой и просушены на воздухе при комнатной температуре, затем они и высушенные белые грибы были измельчены на кусочки размером до 1 см.
Работы по определению сорбции проводились в лабораторной базе ННГУ им. Н. И. Лобачевского. Всего было проведено две серии экспериментов. В первой серии экспериментов навески измельченной капусты и грибов (объемы навесок приблизительно по 200 см 3 ) помещены в мерные стаканы объемом 1 л. Затем они были залиты растворами объемом 400 мл, растворы каждые 10 мин перемешивались стеклянными палочками. Выдержка проводилась при температуре 23 0 С. После выдержки в течение 90 мин растворы были отфильтрованы от сорбентов на бумажных фильтрах синяя лента. Выдержкой продолжительностью 90 мин имитировалось вымачивание продуктов питания перед приготовлением пищи. После контакта раствора катионов меди с измельченными соцветиями цветной капусты раствор приобрел более интенсивный чем изначальный голубой цвет, но примерно после 60 мин выдержки он обесцветился. Предположительно, это свидетельствует о взаимодействии катионов меди с этим «природным сорбентом». Раствор свинца при контакте с измельченными соцветиями цветной капусты приобрел светло-бежевый цвет, затем через 20 мин также обесцветился.


Рис. 1. Цветная капуста и грибы в мерных стаканах с растворами катионов после 10 мин контакта растворов с «природными сорбентами»
После фильтрования в отдельные колбы было собрано по примерно 100 мл растворов. Растворы, которые были в контакте с белыми грибами, окрасились в светло-коричневый цвет. Фильтрат от цветной капусты был бесцветным и прозрачным.


Рис. 2. Фильтрование растворов после выдержки в контакте с сорбентами в течение 90 мин.
Определение содержания свинца, меди в отобранных пробах водных растворах проводилось приборным методом с помощью спектрометра с индуктивно-связанной плазмой Shimadzu ICPE-9820. Этот метод, за счет превращения пробы — водного раствора в плазму высокой температуры, позволяет практически полностью исключить влияние разных веществ, которые образуя с катионами устойчивые химические соединения могут мешать их определению в растворах методами титрования, спектрофотометрии. Все соединения, находящиеся в пробе — водном растворе — будут полностью разрушаться после её подачи с инертным газом носителем в горелку, превращаясь в разряде в ионизированную плазму. Необходимый объем пробы раствора для анализа — 3 мл, что было обусловлено концентрацией определяемых катионов. Калибровка ICP-спектрометра проводилась на стандартных образцах — водных растворах, содержащих известные концентрации катионов меди, свинца. Содержание катионов в пробах проводилась по трем параллельным измерениям для каждой пробы раствора. Результаты измерений масс сорбентов, помещенных в стаканы, концентраций растворов до и после выдержки с сорбентами, среднее значение параллельных измерений содержаний катионов в растворах приведены в таблице 1. Удельная сорбция определялась по формуле:
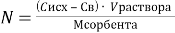
Таблица 1
Результаты измерений массы сорбентов, концентраций ионов в растворах, удельной сорбции
|
№ стакана |
Сорбент |
Масса, г |
Катион |
Концентрация в исходном растворе Cисх, мг/л (ммоль/л) |
Концентрация после выдержки Cв, мг/л (ммоль/л) |
Удельная сорбция N, мг/г (ммоль/г) |
|
1 |
Белые грибы |
38,1 |
Cu 2+ |
94,7 (1,49) |
77,1 (1,21) |
0,18 (0,003) |
|
2 |
Цветная капуста |
111 |
Cu 2+ |
94,7 (1,49) |
40,3 (0,63) |
0,19 (0,003) |
|
3 |
Белые грибы |
37,5 |
Pb 2+ |
115 (0,55) |
48,3 (0,23) |
0,71 (0,003) |
|
4 |
Цветная капуста |
102 |
Pb 2+ |
115 (0,55) |
28,6 (0,13) |
0,34 (0,002) |
Во второй серии экспериментов определялась удельная сорбция катионов меди, свинца на плодовых телах шампиньонов, соцветиях цветной капусты, таблетках активированного угля при комнатной температуре 23 0 С в течение 90 мин, а затем при нагреве растворов с сорбентами до кипения в течение 30 мин, последующем охлаждении пробы до приблизительно 30 0 С и фильтровании. Для второй серии экспериментов были вновь приготовлены растворы солей катионов меди, свинца. Объемы растворов и массы сорбентов были уменьшены по сравнению с первой серией экспериментов. Для грибов, капусты был взят раствор объемом 300 мл, для активированного угля — 100 мл.

Рис. 3. Цветная капуста, шампиньоны, активированный уголь в термостойких стеклянных стаканах залитые водными растворами солей катионов меди, свинца
Выдерживаемые при комнатной температуре растворы с сорбентами помешивали стеклянной палочкой каждые 10 минут, при кипении — каждые 2–3 минуты. После выдержки при комнатной температуре был отфильтрован раствор из каждого стакана. Получился фильтрат объемом приблизительно 10 мл, что хватило для проведения анализа. Отбор такого количества раствора существенно не повлиял на представительность результатов дальнейшего изменения концентрации катионов после выдержки при кипении.
Цветная капуста, грибы, активированный уголь с фильтров были перенесены перед нагревом раствором обратно в стаканы. Содержание катионов в пробах проводилась по трем параллельным измерениям для каждого раствора. Результаты измерений масс сорбентов, помещенных в стаканы, концентраций растворов до и после выдержки с сорбентами, среднее значение трех параллельных измерений содержаний катионов в растворах приведены в таблице 2. Удельная сорбция вычислялась по формуле 1. Отфильтровать активированный уголь после кипячения на бумажных фильтрах синяя лента, а затем красная лента не получилось, так как фильтры сразу забивались мелкими частицами угля и фильтрация останавливалась.
Таблица 2
Результаты измерений, массы сорбентов, концентраций ионов в растворах второй серии экспериментов, удельной сорбции
|
№ стакана |
Сорбент |
Масса, г |
Катион |
Концентрация в исходном растворе, Сисх., мг/л |
Концентрация после выдержки при комнатной температуре Св, мг/л |
Концентрация после выдержки при кипении Св, мг/л |
Удельная сорбция после выдержки при комнатной температуре, N, мг/г (ммоль/г) |
Удельная сорбция после выдержки при кипении, N, мг/г (ммоль/г) |
|
1 |
Шампиньоны |
56,07 |
Cu 2+ |
96,3 |
44,7 |
45,8 |
0,276 (0,0046) |
0,270 (0,0046) |
|
2 |
Цветная капуста |
86,47 |
Cu 2+ |
96,3 |
35,6 |
31,9 |
0,211 (0,0035) |
0,223 (0,0037) |
|
3 |
Активированный уголь |
17,18 |
Cu 2+ |
96,3 |
4,86 |
--- |
0,532 (0,008) |
--- |
|
4 |
Шампиньоны |
82,85 |
Pb 2+ |
106 |
74 |
7,35 |
0,116 (0,0004) |
0,357 (0,0014) |
|
5 |
Цветная капуста |
79,07 |
Pb 2+ |
106 |
27,9 |
18,1 |
0,301 (0,0013) |
0,334 (0,0014) |
|
6 |
Активированный уголь |
17,14 |
Pb 2+ |
106 |
18,2 |
--- |
0,512 (0,0021) |
--- |
По первому этапу экспериментов можно сделать следующие выводы. После выдержки в растворе сульфата меди соцветий цветной капусты, белых грибов можно предположить, что за счет сорбции из раствора концентрация меди в соцветиях капусты и в грибах стала приблизительно в 36 раз больше установленной ПДК для продуктов питания согласно СанПин 42–123–4089–86. После выдержки в растворе ацетата свинца соцветий цветной капусты, белых грибов, можно предположить, что за счет сорбции из раствора, концентрация свинца в грибах стала примерно в 1420 раз выше ПДК согласно СанПин 42–123–4089–86, а в цветной капусте в 680 раз выше ПДК согласно СанПин 42–123–4089–86.
По второму этапу исследований можно констатировать, что шампиньоны лучше сорбируют катионы меди, чем высушенные белые грибы, так как удельная сорбция шампиньонов при комнатной температуре составила 0,276 мг/г, при 0,18 мг/г для белых грибов. Но сорбция ионов свинца существенно лучше у белых грибов, чем у шампиньонов: 0,71 мг/г против 0,116 мг/г. Цветная капуста на втором этапе исследований показала сравнительно близкие результаты по удельной сорбции по сравнению с первым этапом, как для катионов меди, так и для катионов свинца. Медь — 0,19 мг/г первый этап, 0,21 мг/г второй этап, свинец — 0,34 мг/г первый этап, 0,30 мг/г второй этап. Цветная капуста и грибы близки по своим сорбционным свойствам к аптечному активированному углю, а по удельной сорбции свинца сухие белые грибы превосходят активированный уголь.
Выдержка при кипении практически не повлияла на сорбционные свойства шампиньонов и соцветий цветной капусты по отношению к катионам меди, что косвенно может свидетельствовать о сорбции ионов меди за счет возникновения прочных химических связей. Снижение концентрации катионов свинца в растворах после выдержки при кипении в течение 30 мин может свидетельствовать, как об усилении его сорбции соцветиями цветной капусты и плодовыми телами шампиньонов, так и о протекании реакции гидролиза ацетата свинца или его соединений, образовавшихся при взаимодействии катионов свинца с веществами, выделяющимися из «природных сорбентов». Гидролиз может протекать по реакциям 2,3 с выпадением части свинца в виде осадка малорастворимого гидроксида свинца, который может задерживаться фильтрах при фильтрации:
PbОН + + CH 3 COO – + Н 2 О ⇆ Pb(ОН) 2 ↓ + CH 3 COOН (2)
PbОНCH 3 COO + Н 2 О ⇆ Pb(ОН) 2 ↓ + CH 3 COOН(3)
Для проверки этого предположения исходный раствор ацетата свинца кипятили в течение 20 мин, а затем охладили до комнатной температуры. Выпадения осадка, помутнения раствора не наблюдалось. Нельзя исключить вариант выпадения из горячего раствора малорастворимых соединений свинца с органическими веществами, выделяющимися из «природных сорбентов». Данное предположение требует отдельного исследования.
Заключение
- Соцветия цветной капусты, плодовые тела шампиньонов, высушенных белых грибов достаточно эффективно сорбируют катионы меди, свинца из водных растворов их солей при комнатной температуре. Для соцветий цветной капусты экспериментально определенная величина удельной сорбции катионов меди — 0,211 мг/г, свинца — 0,301 мг/г. Для высушенных плодовых тел белых грибов величина удельной сорбции катионов меди — 0,18 мг/г, свинца — 0,71 мг/г. Для плодовых тел шампиньонов величина удельной сорбции катионов меди — 0,276 мг/г, свинца — 0,116 мг/г. Они близки по значениям удельной сорбции к активированному углю, удельная сорбция которого по отношению к катионам меди составила 0,532 мг/г, а свинца — 0,512 мг/г.
- Эффективная сорбция создает опасность отравления катионами меди, свинца овощей, плодовых тел грибов при мытье их от загрязнений, вымачивании в воде, содержащей соли этих катионов в значимых концентрациях — многократно выше установленных для данных катионов ПДК.
Литература:
- Скальный А. В. Химические элементы в физиологии и экологии человека М., Мир, 2004, 215 с.
- Химические основы экологии: учебное пособие/В. Ю. Орлов, А. Д. Котов, А. И. Русаков, И. В. Волкова. — 2-е изд., электрон. — М.: Лаборатория знаний, 2022–353 с.
- Теплая, Г. А. Тяжелые металлы как фактор загрязнения окружающей среды (обзор литературы)/Г. А. Теплая//Астраханский вестник экологического образования. — 2013. — № 1(23). — С. 182–192.
- Влияние свинца на живые организмы/А. Ф. Титов, Н. М. Казнина, Т. А. Карапетян, Н. В. Доршакова//Журнал общей биологии. — 2020. — Т. 81, № 2. — С. 147–160.
- Венецкий С. И. Рассказы о металлах/М.: Металлургия, 1979
- Сайт журнала «Наука и жизнь», https://www.nkj.ru/news/37478/?ysclid=lssoc359eq144173922
- https://dzen.ru/a/YB9LhF-tzCKpyJrZ
- https://www.rgo.ru/ru/article/bolezn-minamata
- Сорбция тяжелых металлов высшими грибами и хитином разного происхождения в опытах in vitro/М. Е. Маркова, В. Ф. Урьяш, Е. А. Степанова, А. Е. Груздева, Н. В. Гришатова, В. Т. Демарин, А. Н. Туманова/ Вестник Нижегородского университета им. Н. И. Лобачевского, 2008, № 6, с. 118–124
- Рябинина Е. И., Зотова Е. Е., Пономарева Н. И., Тимашова А. А., Андреева Н. А. Сорбционная активность свекловичного жома по отношению к ионам свинца — научный журнал «Молодой учёный» № 19 (99), 2015.
- Мыкоц Л. П., Романцова Н. А., Гущина А. В. Изучение сорбционной способности пектина, выделенного из плодов калины обыкновенной, по отношению к ионам свинца — научный журнал «Фундаментальные исследования» № 3, 2013.
- Самойлова, Н. А. Хитин (хитозан)-содержащие композиты для сорбции тяжелых металлов/Н. А. Самойлова, М. А. Краюхина//Известия Уфимского научного центра РАН. — 2018. — № 3–2.
- https://fitaudit.ru/categories/cab/fiber?ysclid=lssq96stbl406205789
- Фундаментальные основы микологии и создание лекарственных препаратов из мицелиальных грибов/Феофилова Е. П., Алехин А. И., Гончаров Н. Г., Мысякина И. С., Сергеева Я. Э. М.: Национальная академия микологии, 2013, 152 с.











