Вариегатность растений давно известна как рецессивный генетический признак высших растений. Вариегатность возникает в результате генетического дефекта, который делает развитие хлоропластов нестабильным, поскольку, по крайней мере, часть тканей дает начало нормальным хлоропластам. Несмотря на то, что растения-мутанты с вариегатными листьями в целом уже давно изучаются в ботанике, подобные мутации все еще недостаточно изучены. Особенно актуальным остается вопрос зависимости вариегатности и различных метаболических факторов, связанных с функциями органелл.
В статье приводятся результаты исследования, основанные на обобщении теоретического материала по вопросам генетических мутаций у растений и проявления вариегатности на листьях растений вследствие генетических мутаций. В эмпирической части исследования проводится сравнительный анализ органоидов листьев вариегатных и «нормальных» растений с помощью оптической микроскопии.
Ключевые слова: вариегатность, генетические мутации растений, морфологические признаки, морфогенетический потенциал.
Вариегатность (от англ. variegated пестрый, разноцветный) — цитоплазматическая мутация, заключающаяся в неспособности групп клеток синтезировать хлорофилл. Отсутствие хлорофилла образует яркое внешнее отличие в виде узоров не зеленого цвета на листовой пластине [2]. В частности, мутации, вызывающие вариегатность, из-за их уникальной особенности наличия как нормальных, так и дефектных пластид в разных участках одной и той же ткани, представляют большой интерес для исследований, направленных на понимание биогенеза хлоропластов, перекрестных связей между ядрами и других ДНК-содержащих элементов клеток, таких как пластиды и митохондрии, и молекулярный механизм вариегатности [6].
Хлоропласты представляют собой пластиды — органоиды клеток, содержащие каротиноиды (пигменты оранжевого цвета) и хлорофилл (пигмент зеленого цвета) за счет которого поглощается солнечная энергия и таким образом осуществляется фотосинтез. У сосудистых растений функциональные хлоропласты отличаются от своих органелл-предшественников, называемых пропластидами. Этот процесс, биогенез хлоропластов, зависит от совокупности экологических, временных и клеточных факторов [8], причем последние включают экспрессию как пластидных, так и ядерных генов. Ядерный геном кодирует подавляющее большинство белков, необходимых для биогенеза хлоропластов. Например, у ячменя (Hordeum vulgare), только 78 из примерно 3000 белков хлоропластов закодированы в пластидном геноме [9]. Мутации в этих ядерных генах могут приводить к дефектным пластидам, о чем свидетельствуют часто встречающиеся аберрации окраски листьев у разных видов растений. Изучение мутаций, вызывающих дефицит хлорофилла, является значимым, так как позволяет понять природу генов ядра клетки, которые участвуют в биогенезе и регуляции хлоропластов.
Вариегатность может проявляться по-разному и может выражаться как появлении бесцветных участков листьев и других частей растения, так и в неравномерной окраске листьев, образующий чаще всего неповторимый рисунок. Особенности проявления вариегатности у каждого растения зависят от его анатомических характеристик [1; 4]. Так, у некоторых растений могут образовываться воздухоносные полости под кожицей листа, что может придать ему серебристую окраску или серебристые штрихи на зеленом листе, у других растений могут быть неравномерно распределены волоски, так что будут присутствовать сегменты, в которых отсутствуют устьица.
Еще одним вариантом вариегатности может стать образование в отдельных клетках растения таких красящих пигментов как антоцианов, придающих красную окраску, или фитомеланинов, придающих черный цвет листьям растения. Но самый распространенный вариант проявления вариегантности — это нарушение синтеза хлорофилла, приводящее к появлению на листе белых, желтых или светло-зеленых участков. При этом такие участки могут иметь различное расположение на листе: как любую неправильную произвольную форму, так и форму штрихов, колец, пятен и т. д. Так как вариегатные растения наряду с нормальными клетками содержат клетки с измененным генетическим составом, то такие клетки являются безхлорофилльными.
В настоящее время вариегатные растения из-за своей причудливой окраски пользуются невероятной популярностью у любителей комнатных цветов (укоренённые черенки некоторых таких растений могут продаваться частными растениеводами по цене 100–200 тысяч рублей за один черенок, см. приложение 1), так и в генетических исследованиях. В исследованиях мутации, вызывающие вариегатность, из-за их уникальной особенности наличия как нормальных, так и дефектных пластид в разных участках одной и той же ткани, вызывают особый интерес в направлениях, направленных на понимание (1) биогенеза хлоропластов, (2) перекрестных связей между ядрами и других ДНК-содержащих элементов клеток, таких как пластиды и митохондрии, и (3) молекулярный механизм вариегатности.
Вариегатность вследствие генетических мутаций является разновидностью так называемого химеризма. Однако не любая вариегатность — это генетическая мутация. Бывают такие варианты вариегатности, которые являются следствием повреждения или отсутствия хлоропластов по другим (негенетическим) причинам.
Понятие «химера» (от греч. Chimaira (Χίμαιρα) — мифологические чудовище с тремя головами и частями тела от представителей млекопитающих) в биологии означает, что в одном организме присутствуют генетически разнородные клетки.
Существует множество классификаций химер по разным признакам (происхождению и причинам мутации, типам пигментации), но в исследовании будет рациональным систематизировать по расположению генотипически разнородных клеток. По такому принципу систематизации, химерность принято делить на четыре вида: периклинальный, секторальный, мериклинальный, мозаичный.
Один из самых распространенных видов химерной вариегатности — периклинальный (см. рис. 1 А). Внешне он представляет собой изменение слоев клеток по периметру листовой пластины. Периклинальная мозаика могут возникать в результате мутаций в начальных клетках апикальной меристемы побега (ткань побега, отвечающая за его рост). Периклинальные мозаики образуются, когда мутация распространяется по всему слою меристемы, создавая однородный, генетически отличный слой клеток.
Так же часто встречающийся вид аберрации — мериклинальный (см. рис. 1 В), образует генотипически различные клетки в определенной части ткани. Как и периклинальный, формируется в стадии образования и деления клеток в апикальной зоне меристемы побега. Считается, что в мериклинальную вариегатность входят ткани периклинальных и секторальных клеток.
Секторальный химеризм приводит к тому, что на листьях растений располагаются крупные участки разнородных тканей (см. рис. 1 Б). Чаще всего такой вариант вариегатности отличает четкая и относительно ровная граница между участками разнородных тканей. Такой вариант вариегатности встречается относительно реже, чем два предыдущих.
Мозаичный химеризм, приводящий к вариегатности, называют еще гиперхимеризм. Этот вариант предполагает, что генетически разные ткани образуют тонкую мозаику, и является наименее распространенным (см. рис. 1).
![Схема видов химер[1]](https://moluch.ru/young/blmcbn/3132/3132.001.jpg)
Рис. 1. Схема видов химер [1]
Так, из-за различий в структуре листьев у однодольных и двудольных вариегатность может проявляться не только пестрой окраской, но и полосатостью у однодольных растений. Например, мутации кукурузы и ячменя являются двумя хорошо изученными примерами, в которых мутации вызывают полосатый фенотип. Они относятся к группе мутантов с идентичным генотипом в зеленых и пигментодефицитных тканях.
Ткани генотипически отличные от клеток, содержащих хлоропласты, менее устойчивы в формировании. В течение роста и развития растения, оно может видоизменяться. Так дорогостоящее вариегатное растение (см. прил. рис. 1) из-за некомфортных для него условий может потерять свою вариегатность («расхимериться») и потерять до 99 процентов своей рыночной цены. Еще одна из значимых сложностей в содержании вариегатных растений это высокая чувствительность к грибковым, вирусным заболеваниям и заражениям вредоносными насекомыми.
Особенностью химерных растений является то, что размножаются они, как правило, только делением куста или дочерними розетками, так как такой тип вариегатности практически не передается по наследству. Даже если при размножении семенами появится вариегатный экземпляр растения, то он будет считаться нестабильной мутацией, что означает крайне низкую вероятность появления вариегатного потомства у него самого.
Для изучения органоидов листьев вариегатных и обычных растений (невариегатных) и для проведения сравнительного анализа строения их клеток на основе микробиологического исследования с помощью светового микроскопа, подготовим временные микропрепараты. Для этого нам потребуются:
- Предметное стекло плоское
- Предметное стекло с углублением
- Пипетка
- Покровное стекло
- Микротом
Также мы использовали следующие материалы и оборудование, необходимые для исследований: микроскоп Levenhuk-320 plus (биологический, лабораторный, увеличение: 40–1600 x, тип насадки: монокуляр, револьверное устройство: на 4 объектива, тип подсветки: светодиодная, расположение подсветки: нижнее, метод исследования: светлое поле, окуляры: WF10x с указателем, WF16x с указателем объективы: ахроматические 4х/0,1; 10х/0,25; 40х/0,65; 100х/1,25 (масляная иммерсия).
Далее необходимо убедиться, что предметное стекло, покровное стекло и пипетка чистые, сухие и не запыленные. Затем перемещаем предметное стекло на чистую сухую поверхность. Кладем в середину предметного стекла заготовленный заранее с помощью микротома заготовку для препарата. Далее с помощью пипетки берем несколько капель исследуемой жидкости, аккуратно выдавливаем каплю жидкости в центр предметного стекла. После этого аккуратно кладем на каплю покровное стекло. Для этого сначала опускаем один его край, потом оставшуюся часть стекла. Опытным путем удалось понять, что не следует прижимать покровное стекло после того, как помещаем его на предметное стекло. Затем берем получившийся препарат и осторожно размещаем его на предметном столике микроскопа.
Для того, чтобы рассмотреть устьица растений, необходимо приготовить несколько срезов нижней эпидермы листа и поместить их на 2 часа в 5 %-ный раствор глицерина. Затем срезы нужно разместить на предметном стекле в том же растворе.
В первую очередь были рассмотрены препараты листовой части растений: Муррайя метельчатая (Murraya paniculata),Эпипремнум Марбл Квин (Epipremnum Marble Queen), Драцена Еллоу Коаст (Dracaena fragrans Yellow Coast), Спатифиллум Пикассо (Spathiphyllum Picasso), Филодендрон Розовая принцесса (Philodendron Pink Princess), Сингониум Эритрофиллум Ред Эрроу (Syngonium erythrophyllum Red Arrow).
На микроснимке Муррайи метельчатой отчетливо видны зеленые клетки, содержащие хлоропласты (рис. 2). В целом можно отметить, что у обычного растения, без генетических мутаций, которой и является Муррайя метельчатая, клетки, содержащие хлоропласты выглядят примерно одинаковыми по форме и размеру, в каждом слое ткани листа имеют относительно равномерную скученность. Как мы сможем увидеть далее, растениям с химерной вариегатностью такая равномерность размеров и расположения клеток уже не присуща.

Рис. 2. Микроснимок — Муррайя метельчатая
На микроснимке листа такого растения как эпипремнум марбл квин можно четко увидеть хлоропласты, заполняющие клетки (рис. 3). Тем не менее не все клетки наполнены пластидами с зеленым пигментом, из-за чего можно сделать вывод о мутации тканей. Такие ткани создают мозаику и достаточно неустойчивы в формировании, следовательно, химеризм этого растения — мозаичный.

Рис. 3. Микроснимок — Эпипремнум Марбл Квин
Для микроснимка кусочка листа драцены еллоу коаст был выбран такой участок листа, который содержит ткани разной пигментации. Как видно на микроснимке (см. рис. 4), выбранный участок содержит лейкопласты и хлоропласты. На полученном препарате хорошо заметна граница мутированных и содержащих хлорофилл клеток. Такое деление говорит о секторальной химерности. Так как фотосинтез осуществляется в тех участках листа, где находятся клетки с хлорофиллом, а вариегатная часть листа получает питание за счет клеток соседнего (невариегатного) участка, то, вероятно, поэтому на границе двух участков мы можем наблюдать сосудистые включения.
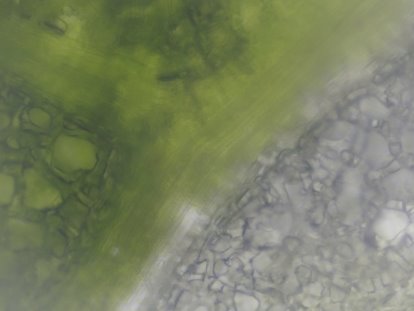
Рис. 4. Микроснимок — Драцена Еллоу Коаст
Смотря на препарат Спатифиллума Пикассо, можно увидеть разнородные клетки содержащие лейкопласты и хлоропласты (рис. 5а, 5б). «Бесцветные» ткани сильнее подвержены заражениям бактериальными и вирусными инфекциями, что было также доказано опытным путем в рамках данного исследования (рис. 5б). Отличные клетки наложены друг на друга и расположены достаточно близко, что свидетельствует о секторальном химеризме.


Рис. 5 а, б. Микроснимок — Спатифиллум Пикассо
Филодендрон Розовая принцесса содержит клетки с лейкопластами, хромопластами и хлоропластами (рис. 6). Ткани распределены слоями, что говорит о секторальном химеризме. Преимущественно, заметны клетки с антоцианами, они придают окраску листьям с красноватым оттенком.

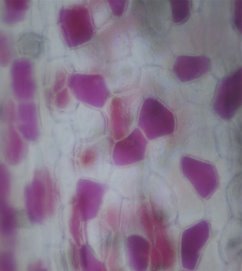
Рис. 6. Микроснимок — Филодендрон Розовая принцесса
На микроснимке Сингониума Эритрофиллума Ред Эрроу можно наглядно рассмотреть ткани, содержащие как клетки с хлорофиллом, так и клетки с антоцианами (рис.7).
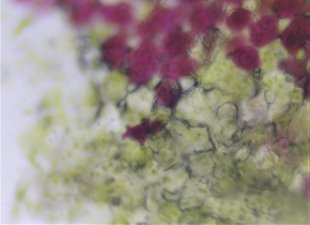
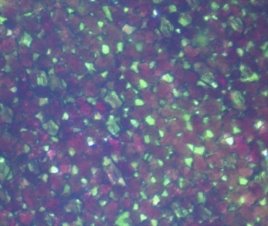
Рис. 7. Микроснимок — Синогниум Ред Эрроу
Таким образом, исследование строения клеток листьев под микроскопом показывает, что у вариегатных растений количество пластид меньше, так как у вариегатных растений либо отсутствуют хлоропласты, либо единичные. Кроме того, у генетически измененных растений в листьях в большом количестве могут обнаруживаться такие пигменты, которые у обычных растений чаще всего отсутствуют. Причем ряд из этих пигментов, не способны участвовать в фотосинтезе (например, антоцианы).
Литература:
- Н. П. Кренке. Химеры растений / [Предисл. В. Рыжкова, с. 3–6]; Акад. наук СССР. Гл. ботан. сад. — Москва; Ленинград: Изд-во и 2-я тип. Изд-ва Акад. наук СССР, 1947 (Москва). — 388 с., 5 л. ил.: ил.; 22 см.
- Малясова А. С. Хлорофилл: история открытия и установления структуры // Российский химический журнал. — 2017. — Т. 61. — № 3. — С. 3–10.
- Молекулярно-генетические и физиологические особенности хлорофилл-дефицитных мутантов подсолнечника с внеядерным типом наследования / М. С. Макаренко, А. А. Ковалевич, Т. В. Шамова [и др.] // Живые и биокосные системы. — 2019. — № 27. — С. 4.
- Рябушкина Н. А. Клональная и микроклональная изменчивость растений // Биотехнология. Теория и практика. — 2014. — № 2. — С. 17–27.
- Стрыгина К. В., Хлесткина Е. К. Синтез антоцианов у картофеля (Solanum tuberosum l.): генетические маркеры для направленного отбора // Сельскохозяйственная биология. — 2017. — Т. 52. — № 1. — С. 37–49.
- Чесноков Ю. В., Косолапов В. М., Савченко И. В. Морфологические генетические маркеры у растений // Генетика. — 2020. — Т. 56. — № 12. — С. 1366–1377.
- Ясинская Д. С. Хлорофиллы и ксантофиллы листьев древесных растений // Научный журнал молодых ученых. — 2018. — № 4(13). — С. 11–15.
- Pogson B. J., Albrecht V. Genetic dissection of chloroplast biogenesis and development: an overview // Plant Physiol. — 2011. — No. 155 (4). P. 1545–1551.
- Saski C., Lee S. B., Fjellheim S., Guda C., Jansen R. K., Luo H., Tomkins J., Rognli O. A., Daniell H., Clarke J. L. Complete chloroplast genome sequences of Hordeum vulgare, Sorghum bicolor and Agrostis stolonifera, and comparative analyses with other grass genomes // Theoretical and Applied Genetics. — 2007. Np. 115. P. 571–590.
[1] Схема разработана автором на основе обобщения информации из исследований, указанных в списке источников.











