Влияние иммобилизационного стресса на активность и топографию энтеральных ферментов на фоне введения феназепама
Авторы: Абдувахабова Нилуфар Абдусаид кизи, Аскарьянц Вера Петровна
Рубрика: 3. Медико-биологические дисциплины
Опубликовано в
IV международная научная конференция «Медицина и здравоохранение» (Казань, май 2016)
Дата публикации: 25.02.2016
Статья просмотрена: 219 раз
Библиографическое описание:
Абдувахабова, Н. А. Влияние иммобилизационного стресса на активность и топографию энтеральных ферментов на фоне введения феназепама / Н. А. Абдувахабова, В. П. Аскарьянц. — Текст : непосредственный // Медицина и здравоохранение : материалы IV Междунар. науч. конф. (г. Казань, май 2016 г.). — Казань : Бук, 2016. — С. 9-11. — URL: https://moluch.ru/conf/med/archive/194/9799/ (дата обращения: 18.05.2024).
В стрессорную реакцию организма почти всегда вовлекаются органы пищеварения. Агрессивность является важной формой зоосоциального поведения у животных разных видов, имеющая приспособительное значение и проявляющаяся видоспецифическим набором поведенческих реакций (2,4). Но особенности функционирования органов пищеварения в зависимости от поведенческих характеристик организма изучены недостаточно, ни в норме, ни при стрессе.
Актуальностью работы явилось выяснение функционального состояния тонкой кишки у крыс из агрессивной группы при иммобилизационном стрессе под влиянием транквилизатора феназепама.
Цель работы: изучения влияния феназепама на активность и топографию энтеральных ферментов у крыс из агрессивной группы в условиях иммобилизационного стресса.
Материалы иметоды: эксперименты проводились на взрослых беспородных крысах с массой тела 180–200 г. Использовались три группы крыс — смешанная (животные не проверялись на агрессивность), неагрессивная и агрессивная группы.
Животные проверялись на агрессивность по методике А. А. Рылова (1983); раздражителями являлись электрические импульсы, каждый из которых предъявлялся животным четырехкратно. Величина агрессивности, связанная с болью, оценивалась по показателю «средней болезненности схваток», возникающих в ответ на серию из 88 импульсов и количеству схваток из 88 возможных. Агрессивными крысами считаются те, у которых «средняя болезненность схваток» находится в пределах от 45,6 до 39,7. У крыс со средней агрессивностью этот показатель колеблется от 38,8 до 33,4. У неагрессивных особей он составляет 32,6–0.
Иммобилизационный стресс вызывали путем принудительной иммобилизации в течение 24 часов.
Феназепам вводили перорально с профилактической целью за 30 минут до стресса в дозе 2 мг/кг. В качестве контроля использовали крыс с соответствующей типологической характеристикой, которым перорально вводили эквивалентное количество дистиллированной воды. Массу тела и массу слизистой определяли обычным взвешиванием.
Активность пищеварительных ферментов определялась по следующим методикам: моноглицеридлипазы — методом А. М. Уголева и М. Ю. Черняховской(1969); глицил-1-лейцин — дипептидгидролаза — методом А. М. Уголева и Н. М. Тимофеевой (1969), амилазы — методом Смит-Роя в модификации А. М. Уголева (1969); сахаразы — методом Neleon в модификации А. М. Уголева и Н. Н. Иезуитовой (1969), лактазы — методом Dalhgvist (1968).
Активность ферментов рассчитывалась на 1 г массы сырой ткани слизистой оболочки тонкой кишки и выражалась в мг/мин/г для амилазы и в мкмоль/мин/г для остальных ферментов.
Статистическая обработка данных проводилась методом Стьюдента-Фишера.
Результат исследований: в этой серии опытов контролем служили показатели у интактных крыс из агрессивной группы.
В группе агрессивных крыс стресс привел к гибели 2-х особей из 10, подвергнутых иммобилизации, т. е. среди них летальность составляла 20 %.
Иммобилизация снижала массу тела у агрессивных крыс до 48-го часа включительно после стрессорного воздействия в 1,2 раза.
Масса слизистой оболочки уменьшалась через 6 ч и 24 ч после стресса вдоль всей тонкой кишки, особенно в двенадцатиперстной кишке и проксимальном отделе. Через 48 ч показатель нормализовался.
Активность большинства ферментов в гомогенате силизистой оболочки, снятой вдоль всей тонкой кишки, снижалась. Так, активность моноглицеридлипазы угнеталась в 1.7; в 1.8; в 2,3 раза через 6, 24, 48 ч соответственно.
Активность дипептид гидролазы уменьшалась в 1,8 раза и в 2,6 раза через 6 ч и 24 ч; нормализация произошла через 48 ч.
Амилолитическая активность ингибировалась на протяжении всего эксперимента в 1,6 раза, в 1,4 раза, в 2 раза (табл).
Таблица
Активность амилазы (мг/мин/г) вгомогенате слизистой оболочке, снятой вдоль всей тонкой кишке при иммобилизационном стрессе ипри стрессе на фоне феназепама укрыс из агрессивной группы. (М±m, n=6).
|
Условия эксперимента |
Время вчасах после стресса |
||
|
6 |
24 |
48 |
|
|
Интактные крысы (контроль) |
260,0±2,9 |
260,0±2,9 |
324,0±30,2 |
|
Иммобилизационный стресс |
165,0±9,5 p < 0,01 |
187,3±10,6 р < 0,05 |
158,3±5,4 р <0,001 |
|
Иммобилизационный стресс на фоне феназепама |
286,0±5,2 р >0,05 |
273,3±5,9 р >0,05 |
313,5±5,7 р >0,1 |
Сахаразная активность не изменялась через 6 ч после стресса и уменьшалась в 1,7 раза и в 1,5 раза через 24 ч и 48 ч после иммобилизации.
Лактазная активность не изменялась через 6 ч и 48 ч, но понижалась в 1,5 раза через 24 ч.
Распределение ферментативных активностей после стресса становилось равномерным вдоль всей кишки.
Активность моноглицеридлипазы снижалась в одинаковой степени во всех участках тонкой кишки через 6, 24, 48 ч, поэтому распределение ее оставалось таким же равномерным, как в контрольной группе.
Дипептидгидролазная активность снижалась через 6 ч и 24 ч в дистальном сегменте и не изменялась в остальных сегментах, вследствие чего ее распределение выровнялось на протяжении органа. Через 48 ч топография соответствовала контрольной, т.е вновь пик активности фермента сместился в дистальный сегмент, а в остальных отделах активность была ниже и, примерно, равна между собой.
Амилолитическая активность через 6, 24, 48 ч снижалась в двенадцатиперстной кишке и в проксимальном отделе и не изменялась относительно контроля в медиальном и дистальном сегментах, что способствовало выравниванию ее распределения на протяжении кишки.
Сахаразная активность через 6 ч после стресса не изменялась во всех сегментах, поэтому топография ее не отличалась от таковой в контроле — пик активности определялся в двенадцатиперстной кишке, далее активность снижалась в каудальном направлении. Через 24 ч и 48 ч после иммобилизации активность энзима ингибировалась в двенадцатиперстной кишке и проксимальном сегменте и не изменялась в 2-х каудальнее расположенных отделах, поэтому распределение ее стало равномерным (рис).
Активность лактазы через 6 ч и 48 ч после стресса не отличалась по величине от контрольной на всех участках кишки и топография ее была как в контроле, т.е наиболее высокая активность в двенадцатиперстной кишке, меньшая и примерно одинаковая между собой — в 3-х остальных сегментах. Через 24 ч после стресса активность лактазы ингибировалась а всех участках кишки, но больше — в двенадцатиперстной кишке, что привело к выравниванию ее распределения.
Профилактическое введение феназепама эффективно предупреждало развитие негативных последствий от иммобилизационного стресса у агрессивных крыс: во все сроки после стресса не менялись масса тела и масса слизистой, не наблюдалось изменение активности моноглицеридлипазы, дипептидгидролазы, амилазы (табл) и лактазы в гомогенате слизистой оболочки, снятой вдоль всей тонкой кишки. Только активность сахаразы повышалась в 1,8 раза через 24 ч.
Топография ферментативных активностей нарушалась без определенной системы через 6 ч, но уже через 24 ч для большинства ферментов топография соответствовала контролю (рис).
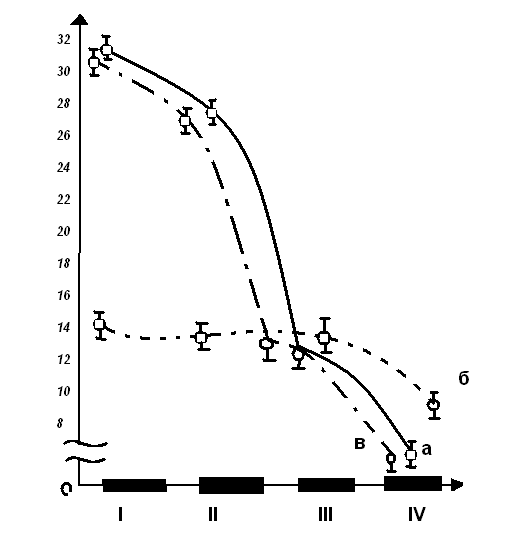
Рис. Распределение активности сахаразы вдоль тонкой кишки через 24 часа после стресса, а также после стресса на фоне феназепама. Ось абсцисс — отделы тонкой кишки (I-двенадцатиперстная, II-проксимальный, III-медиальный, IV-дистальный). Ось ординат — активность фермента в мкмоль/мин/г): а — интанктные крысы, б- иммобилизация, в — иммобилизация на фоне феназепама
Выводы:
У взрослых агрессивных крыс иммобилизация вызывает гибель 20 % особей, ингибирует активность всех ферментов, а распределение ферментативных активностей становится равномерным по длине тонкой кишки;
Общим для стресса всех взрослых крыс является снижение массы тела и массы слизистой оболочки;
Феназепам четко корректирует нарушения в морфо-функциональном состоянии тонкой кишки, что проявляется более быстрой нормализацией исследованных показателей.
Литература:
- Cox T; Stress, coping and problem solving// Work and stress.- 2001. — № 1.- P.5–14.
- Palmour R. M. Genetic models for study of aggressive behavior// Progr.neuropsychopharmasol and biol.psychiatr.- 2002.- V.7.-P.513–516.
- Уголев А. М. Физиология и патология пристеночного (контактного) пищеварения. С.-Пб. Наука, 2001.-230с
- Фурдуй Ф. И. современные представления о физиологических механизмах развития стресса.-Кишинев, 2001.-с.8–33.
Похожие статьи
Влияние стресса на функциональное состояние тонкой кишки...
Топография всех ферментативных активностей изменяется, в основном, за счет смещения их максимума в дистальный сегмент.
Основные термины (генерируются автоматически): неагрессивная группа, слизистая оболочка, тонкая кишка, крыса, стресс.
тонкая кишка, стресс, активность, двенадцатиперстная кишка...
Влияние иммобилизационного стресса на активность... тонкая кишка, стресс, активность, двенадцатиперстная кишка, слизистая оболочка, агрессивная группа, крыса, раз, масса тела, дистальный сегмент.
Лимфоидная ткань кишечника как основа иммунной системы...
Статья просмотрена: 978 раз.
а) резкая атрофия слизистой оболочки тонкой кишки. Основные термины (генерируются автоматически): тонкая кишка, растущий организм, поджелудочная железа, пищеварительная система, мембранное пищеварение...
Развитие кишечного пищеварения в раннем онтогенезе при...
а) резкая атрофия слизистой оболочки тонкой кишки; б) увеличение массы печени
слизистая оболочка, пищеварительный тракт, лимфоцит, антиген, клетка, иммунная система, тонкая кишка, внешняя среда, бляшка, главная функция.
Статистика заболеваний желудочно-кишечного тракта: причины...
В последнее десятилетия в разы увеличилось количество заболеваний двенадцатиперстной кишки и желудка.
Взаимосвязь инфицированности helicobacter pylori... вторичная язва желудка, язвенная болезнь, слизистая оболочка желудка, дуоденальная язва, желудочный...
Особенности дифференцировки клеток эпителиального слоя...
Поэтому наши исследования посвящены вопросам закладки, дифференцировки и становления функций клеток эпителиального слоя слизистой оболочки тонкой кишки в эмбриогенезе.
Материалом исследования служили двенадцатиперстная, тощая и подвздошная кишки.
Клинический случай лазеротерапии язвенной болезни...
Биологическая активность аурикулярных точек аналогична таковой акупунктурных точек тела, но электрофизиологические показатели их всегда выше корпоральных.
кишки (70–95 %), а также при эрозиях слизистой оболочки желудка (СОЖ), неязвенной диспепсии.
Влияние экспериментальной анемии матери и/или потомства на...
Влияние стресса на функциональное состояние тонкой кишки крыс. Актуальностью работы явилось выяснение функционального состояния тонкой кишки у крыс из неагрессивной группы при стрессе под влиянием транквилизатора феназепама.
Психосоматические аспекты язвенной болезни желудка...
Среди взрослого населения составляет около 7–10 %, а двенадцатиперстной кишки в 4 раза чаще [1]. Целью моей работы явилось изучение влияний
Начинается с симптомов нарушения пищеварения: изжогой, отрыжкой кислым, нарушением стула, снижением массы тела.
Похожие статьи
Влияние стресса на функциональное состояние тонкой кишки...
Топография всех ферментативных активностей изменяется, в основном, за счет смещения их максимума в дистальный сегмент.
Основные термины (генерируются автоматически): неагрессивная группа, слизистая оболочка, тонкая кишка, крыса, стресс.
тонкая кишка, стресс, активность, двенадцатиперстная кишка...
Влияние иммобилизационного стресса на активность... тонкая кишка, стресс, активность, двенадцатиперстная кишка, слизистая оболочка, агрессивная группа, крыса, раз, масса тела, дистальный сегмент.
Лимфоидная ткань кишечника как основа иммунной системы...
Статья просмотрена: 978 раз.
а) резкая атрофия слизистой оболочки тонкой кишки. Основные термины (генерируются автоматически): тонкая кишка, растущий организм, поджелудочная железа, пищеварительная система, мембранное пищеварение...
Развитие кишечного пищеварения в раннем онтогенезе при...
а) резкая атрофия слизистой оболочки тонкой кишки; б) увеличение массы печени
слизистая оболочка, пищеварительный тракт, лимфоцит, антиген, клетка, иммунная система, тонкая кишка, внешняя среда, бляшка, главная функция.
Статистика заболеваний желудочно-кишечного тракта: причины...
В последнее десятилетия в разы увеличилось количество заболеваний двенадцатиперстной кишки и желудка.
Взаимосвязь инфицированности helicobacter pylori... вторичная язва желудка, язвенная болезнь, слизистая оболочка желудка, дуоденальная язва, желудочный...
Особенности дифференцировки клеток эпителиального слоя...
Поэтому наши исследования посвящены вопросам закладки, дифференцировки и становления функций клеток эпителиального слоя слизистой оболочки тонкой кишки в эмбриогенезе.
Материалом исследования служили двенадцатиперстная, тощая и подвздошная кишки.
Клинический случай лазеротерапии язвенной болезни...
Биологическая активность аурикулярных точек аналогична таковой акупунктурных точек тела, но электрофизиологические показатели их всегда выше корпоральных.
кишки (70–95 %), а также при эрозиях слизистой оболочки желудка (СОЖ), неязвенной диспепсии.
Влияние экспериментальной анемии матери и/или потомства на...
Влияние стресса на функциональное состояние тонкой кишки крыс. Актуальностью работы явилось выяснение функционального состояния тонкой кишки у крыс из неагрессивной группы при стрессе под влиянием транквилизатора феназепама.
Психосоматические аспекты язвенной болезни желудка...
Среди взрослого населения составляет около 7–10 %, а двенадцатиперстной кишки в 4 раза чаще [1]. Целью моей работы явилось изучение влияний
Начинается с симптомов нарушения пищеварения: изжогой, отрыжкой кислым, нарушением стула, снижением массы тела.











