В статье рассмотрены различные способы выделения меди из отработанных растворов травления. Предложен вариант замены хлорида аммония хлоридом натрия в качестве нового или дополнительного источника хлорид-ионов, предложена технологическая схема переработки отработанных растворов травления.
Ключевые слова: травление, электроэкстракция, хлорид аммония, хлорид натрия, электроэкстрация.
С начала ХХ века процессы изготовления печатных плат непрерывно совершенствовались. Одним из важнейших процессов является травление, которое необходимо для получения токопроводящего рисунка печатной платы. В качестве травителей используют растворы хлорного железа, аммиака и т. п.. На данный момент основным раствором травления является солянокислый раствор хлорида меди (таблица 1), т. к. он обеспечивает достаточную скорость и качество травления. Но использование такого раствора имеет свои недостатки: при травлении большое количество меди переходит в раствор, что вызывает уменьшение эффективности травильной ванны. Для того, чтобы поддерживать высокую эффективность и стабильную скорость травления печатных плат необходимо регенерировать травильный раствор и удалять избыток меди.
Таблица 1
Химический состав исходного травильного раствора
|
Наименование вещества |
Количество вещества, на 1 дм 3 |
|
CuCl 2 × 2H 2 O |
187 г/дм 3 |
|
NH 4 Cl |
32 г/дм 3 |
|
HCl |
257 см 3 |
|
H 2 O 2 +H 2 O |
132 см 3 + 392 см 3 |
* Рабочая концентрация меди в исходном растворе 60 г/дм 3
Из-за сложности химического состава отработанного раствора травления (ОТР) и его относительной токсичности (таблица 2), предприятия его никак не перерабатывают, а складируют и отправляют на утилизацию.
Для того, чтобы вернуть раствор в оборот, необходимо снизить концентрацию меди с 150 г/дм 3 до 60 г/дм 3 и окислить соединения одновалентной меди, чтобы могли протекать основные реакции травления:
|
Cu + CuCl 2 + 2HCl = 2H [CuCl 2 ] |
|
Cu + H 2 O 2 + 2HCl = CuCl 2 р - р + 2H 2 O |
Таким образом, если выполнить эти два условия, то можно создать замкнутую систему, в которой раствор можно будет регенерировать, выделяя при этом медь.
Таблица 2
Концентрация основных веществ в отработанном растворе травления
|
Наименование вещества |
Концентрация вещества г/дм 3 |
|
Cu р-р |
150 |
|
HCl |
11,7 |
С учетом вышесказанных требований, для удаления избытка меди из раствора были рассмотрены следующие методы: цементация, нейтрализация, реагентный метод. Все перечисленные методы имеют свои достоинства и недостатки (таблица 3).
Таблица 3
Сравнение вариантов переработки отработанных растворов травления
|
Метод |
Плюсы |
Минусы |
|
Нейтрализация |
Дешевые реагенты Простота |
Необоротные растворы Не окисляет ионы Cu + |
|
Реагентный метод |
Доступность Простота |
Необоротные растворы |
|
Цементация |
Извлечение меди 99,5 % Простота |
Необоротные растворы Не окисляет ионы Cu + Вносятся ионы другого металла |
|
Электрохимические методы |
Не вносят ничего лишнего Оборотный раствор Окисляют ионы Cu + в Cu 2+ |
Выделение аммиака Выделение хлора Сложность аппаратурного оформления |
Наиболее привлекательным методом выделения меди из кислых растворов является электроэкстракция, задачи которой, в нашем случае, состоят в следующем:
окислить Cu + до Cu 2+ ;
снизить концентрацию меди в растворе с 150 г/дм 3 до 60 г/дм 3 ;
получить металлическую медь.
Предлагаемая схема переработки растворов приведена на рисунке 1.
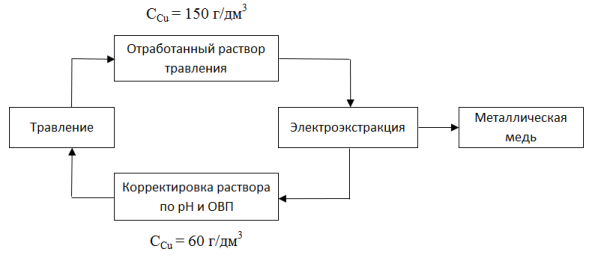
Рис. 1. Предлагаемый способ переработки ОТР
Основной проблемой при электроэкстракции меди из ОТР является большое выделение хлора на аноде, и аммиака на катоде. Для того, чтобы снизить или полполностью предотвратить выделение хлора на аноде и выделение аммиака на катоде можно предложить следующие технологические решения:
заменить реагент хлорид аммония, который выступает в качестве источника дополнительных хлор-ионов при травлении;
снизить концентрацию хлор-иона в растворе до электроэкстракции.
Для проверки предлагаемых вариантов провели ряд экспериментов по поиску аналога хлорида аммония. Усредненные результаты экспериментов представлены в таблице 4.
Таблица 4
Сравнение хлорида аммония и хлорида натрия
|
V, см 3 |
Количество растворенной меди, г |
NH 4 Cl, г |
NaCl, г |
Количество растворенной меди, г |
|
|
Модельный раствор 1 |
100 |
4,5 |
3,2 |
- |
5,1 |
|
Модельный раствор 2 |
100 |
4,4 |
- |
3,2 |
5,1 |
На основании экспериментальных данных можно сделать вывод, что способность NaCl выступать в качестве дополнительного источника ионов хлора сопоставима с NH 4 Cl. Скорость травления при введении NaCl не меняется.
В качестве дальнейших исследований предлагается проводить электроэкстракцию с нейтральными (в частности, графитовыми) электродами, разделенными катионитовой мембраной. После охлаждения раствор будет подаваться в анодное пространство электролизера, где часть ионов Cu (I) окисляется до Cu (II). Другая часть ионов проходит мембрану и восстанавливается на катоде до металлического состояния Cu 0 . Таким образом, анодное пространство насыщается ионами Cu (II), за счет того, что они не могут восстановиться на катоде до Cu 0 .
Для уменьшения выделения хлора предлагается использовать дополнительное дехлорирование, или вести процесс до окончания окисления меди Cu (I) в Сu (II), так как после этого потенциал анода сдвигается в положительную сторону и начинается опасное выделение хлора.
Литература:
- Гончаренко, Т. П. Методика обезвреживания и утилизации отработанного медно-хлоридного раствора травления [Текст] / Т. П. Гончаренко, А. Г. Гончаренко, Г. И. Елагин // Вестник Черкасского национального университета им. Богдана Хмельницкого. Серия химические науки. — 2010.
- Кругликов, С. С. Регенерация травильных растворов и рекуперация меди в производстве печатных плат [Текст] / С. С. Кругликов // Гальванотехника и обработка поверхности. -1993. — том 2. — выпуск 4.
- Тураев, Д. Ю. Журнал прикладной химии [текст] / Д. Ю. Тураев, С. С. Кругликов, А. В. Парфенова // Российский химико-технологический университет им. Д. И. Менделеева, Москва. — 2005. -Т. 78. — Выпуск 9.
- Шкундина, С. Прецизионное травление печатных плат [Текст] / С. Шкундина // Производство электроники: Технологии. Оборудование. Материалы. — 2011.
- Электролиз, электроды [Электронный ресурс] // Справочник химика 21 — химия и химическая технология. — Режим доступа https://chem21.info/info/149644/.







