Незамещенные в положении 3 хиназолоны-4 чрезвычайно устойчивы к окислению, восстановлению и гидролизу. Даже дымящая азотная кислота не способна к окислению хиназолона-4 1 в 2-метилхиназолона-4. Окисление хиназолона-4 перманганатом калия или хромовой кислотой дает хиназолиндион-2,4.
В отличие от хиназолонов-4 окисление хиназолина в кислой среде перманганатом калия, перекисью водорода, а также 3,4-дигидрохиназолинов, 4-метил-, хлор-, -амино-, меркап-тохиназолинов протекает легко и дает соответствующие хиназолоны-4. Окисление хиназолина в жестких условиях приводит к разрушению бензельного кольца и образованию 4,5-пи-римидиндикарбоновой кислоты.
АЛКИЛИРОВАНИЕ ХИНАЗОЛОНОВ-4
Алкилирование производных хиназолина протекает в разных направлениях. Натриевые и калиевые соли хиназолона-4 алкилируются йодистым метилом в спиртовом растворе или диметил-сульфатом, образуя только З-метилхиназолоны-4. Подобным образом идет алкилирование хиназолона-4 бромкетонами, диалкиламино полиметилен хлоридами, производными 6-хлоракриловой кислоты, а также 2-гало-генхиназолонов-4 галоидкетонами и амидами галоидкислот в присутствии щелочи. В отличие от этого хиназолон-4 и его замещенные реагируют с бромистыми алкилами в присутствии поташа или гидрида натрия в диметилформамиде и в зависимости от заместителей дают продукты алкилирования либо кислородного атома, либо атома азота в положении 3, а реакция 4-аминохиназолина с бромкетонами приводит к 1- [1,4-ди-гндрохиназолон-4-ил]кетонам.
При алкилировании серебряной соли хиназолона-4 образуется смесь О- и N-метилхиназолонов-4 c преобладанием N-изомера. Алкилирование натриевых солей йодистым этилом дает смесь, и на, в которой первый образуется количестве в случае же использования серебряной соли преобладает этоксихиназолин.
Протекание раекции алкилирования хиназолонов-4 в разных, направлениях является результатом существования их в таутомерных формах А, В, С:
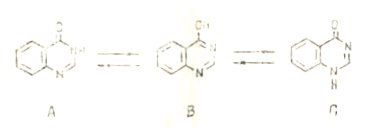
Сравнение УФ-спектров хиназолона-4, 4-метоксихиназолина, 3 метилхиназолона-4 и 1-метилхиназолона-4 показывает, что форм. А предпочтительнее формы С. Спектральные исследования и измерения значения рКа показывают, что соотношение А:В:С для хиназолона-4 составляет приблизительно 7:2:1, что указываем на существование хиназолонов-4 в основном в виде оксотаутомеров А. В щелочном растворе хиназолоны-4 существуют в виде амбидентьных анионов, поэтому реакция идет по разным реакционный центрам, а направление ее зависит от природы заместителей в положении 2 или 4 и в ароматическом кольце.
РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ В ПОЛОЖЕНИИ-4
Хиназолоны-4, не имеющие заместителей в положении 3, легко вступают в реакцию с хлорангидридами неорганических кислот (хлористый тионил, хлорокись фосфора, пятихлористый фосфор) и образуют 4-хлорхиназолины. Если же в положении 3 имеется метильная группа, то при взаимодействии с хлорангидридами неорганических кислот она отщепляется и образуются 4-хлорхиназолины. Эта реакция является простым методом получения 4-хлорхиназолинов. Однако 5-нитрохина-золон-4 не реагирует даже с избытком пятихлористого фосфора в различных условиях.
Атом хлора в 4-хлорхиназолинах, как и в других гетероциклах, очень подвижен. Он легко гидролизуется, вступает в реакцию нуклеофильного замещения, реагирует с цианид ионом, со спиртами, меркаптанами, аммиаком, аминами, аминоспиртами, производными гидразина, соединениями, содержащими активированную метиленовую группу и др. При этом образуются 4-циано-, алкокси-, -амино-, -гидразино- и т. д. хиназолины. Реакция катализируется кислотами и основаниями. В качестве оснований используют воду, гидроокиси щелочных металлов, спирт, алкоголяты и феноляты металлов, сероводород и др. В присутствии сильного основания (например, едкого натра или метилата натрия) реакция протекает при комнатной температуре, при слабых основаниях (вода, спирты, ароматические амины) требуется повышенная температура или следы кислот.
Нуклеофильное замещение 4-хлорхиназолина сопровождается всегда выделением свободного хлористого водорода, поэтому в дальнейшем реакция идет аутокаталитически. Этим объясняется превращение 4-хлорхиназолина в хиназолон-4 под действием влаги или образование 4-метоксихиназолина при выдерживании метанольного раствора 4-хлорхиназолина в течение нескольких анионными реагентами объясняется тем, что атом галогена часов при комнатной температуре.
Большая легкость нуклеофильной замены атом а галогена наспится в положении к атому азота в положении 3 и в п — положение к N-1. Это обусловливает образование двух промежуточных. Активированных резонансных структур, от которых отщепление хлористого водорода протекает с большой скоростью:
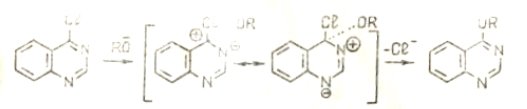
Сильная каталитическая роль кислот в данной реакции заключается в том, что они образуют соли хиназолина, которые легко существуют в различных формах, благоприятствующих нуклеофильной атаке.
Нуклеофильное замещение в положении 4 для хиназолонов-4 затруднено. Однако 4-тиохиназолин или 4-метилтиоханазолин могут превращаться в 4-аминохиназолин при обработке аммиаком или аминами. Аналогичное замещение наблюдается и для 4-метокси-хиназолина.
Производные хиназолона-4 под действием пятисернистого фосфора превращаются в 4-тиохиназолины.
РЕАКЦИИ, ПРОТЕКАЮЩИЕ ПО~ МЕТИЛЕНОВОЙ ГРУППЕ 2-АЛКИЛХИНАЗОЛОНОВ-4
Бромирование и хлорирование хиназолонов-4
Метиленовая группа 2-алкилхиназолонов-4 активирована как и в других гетероциклических системах. Поэтому она легко вступает в реакции галогевирования, формилирования ацилирования и т. д.
Известно, что атомы водорода метальной группы в α-положении хиназолина могут замещаться бромом в условиях как радикальнқх, так и ионных В качестве примера радикального бромирования можно привести взаимодействие 2-алшл 3,458 дрохиназолонов-4 N-бромсукцинимидом в присутствии пе-11 е1<;цси бензоила, которое дает 2-бромалкилзамещенные. Так, бронирование 2-метил-3-фенил-3,4-дигидрохиназолона-4 приводит к бромметил- 3-фенил-3, 4-дигидрохиназолону-4:

Аналогичные результаты получены при бромировании 1,2,3,9-тетрагидроп ирроло хиназолона-9 и его 6-метокси-ироизводного.
Направление реакции бромирования 2-метил-3-алкиларил-3,4- дигидр охиназолонов-4 зависит от многих факторов: используемого катализатора, растворителя, места расположения метальной группы в ароматическом цикле и др. Если при взаимодействии 2-метил-3-п-толил-3,4-дигидрохиназолона-4 с N-бромсукциними дом в ледяной уксусной кислоте выделено а-монобромметилпронзводное, то в присутствии бромистого водорода получена его смесь с 2-дибромметил-3-п-толил-3,4-дигидрохиназолоном-4.
При использовании соотношения реагентов 1:2 образуется 2-метил-3- [(п-дибромметил)-фенил]-3,4-дигидрохиназолон-4:
Литература:
- Х. М. Шахидоятов «Хиназолоны-4 и их биологическая активность» Ташкент. издателство «фан» 1988
- Б. А. Павлов «Органическая химия» Ташкент. издателство «ўқитувчи» 1988







