Колоректальный рак остается одной из значимых позиций в структуре онкологической заболеваемости и смертности. В последнее десятилетие в качестве его прекурсоров помимо классических аденом рассматривают особую группу, выделенную на основе общности морфологии, — зубчатые образования. Представители данной группы обладают выраженной молекулярно-генетической гетерогенностью и реализуют свой злокачественный потенциал через специфические механизмы — так называемый зубчатый путь канцерогенеза. Несмотря на это, сегодня группа зубчатых образований остается малоизученной и недостаточно широко освещенной, и сохраняется множество вопросов, связанных с отсутствием для нее общепринятых диагностических критериев и молекулярно-генетическим профилем образований. Ниже приведены и охарактеризованы наиболее значимые классификационные позиции, а также рассмотрены особенности озлокачествления зубчатых образований.
Ключевые слова: зубчатые образования, колоректальный рак, зубчатый путь канцерогенеза.
На злокачественные опухоли ободочной кишки в Российской Федерации на 2015 год приходилось 6,6 % всей онкологической патологии, на опухоли прямой кишки, ректосигмоидного соединения и ануса — 4,9 %; при этом в структуре смертности эти группы опухолей составили 15,9 % у женщин и 11,5 % у мужчин. [1] Распространенность этой группы новообразований диктует необходимость выявления их на этапе предраковых изменений. До недавнего времени считалось, что в качестве таковых могут выступать только так называемые диспластические полипы (аденомы тубулярные, тубуло-ворсинчатые, ворсинчатые), причем чем более выражен ворсинчатый компонент, тем интенсивнее выражена дисплазия, а значит, тем выше потенциал злокачественности. Представители другой группы новообразований — гиперпластические полипы — считались не способными к перерождению в аденокарциному. [2, 3] Однако сегодня доказано, что они представляют собой гетерогенную группу образований с различным неопластическим потенциалом, для обозначения которой предложен термин — зубчатые образования толстой кишки. Несмотря на то, что зубчатые новообразования впервые были описаны несколько десятилетий назад, они остаются одним из самых малоизученных и недостаточно точно идентифицируемых видов кишечных полипов. [4]
История вопроса
Первые упоминания новообразований с зубчатой морфологией были сделаны в 1984 г. S. Urbanski и соавт. [5]; в 1990 г. T. Longacre и C. Fenoglio-Preiser для таких образований впервые предложили термин «зубчатая аденома» [6] Тем не менее, клиническое значение зубчатых образований оставалось неясным до 2003 года, когда Goldstein и соавт. связали их с развитием рака толстой кишки. [7]
С 2010 года зубчатые новообразования толстой кишки включены в классификацию ВОЗ в качестве предопухолевых поражений. Критерием, лежащим в основе выделения образований в отдельную группу, служит специфическая зубчатая (пилообразная) архитектоника крипт [8]. В современной классификации зубчатые образования толстой кишки разделены на три основные категории: гиперпластический полип, зубчатая аденома/полип на широком основании и традиционная зубчатая аденома (рисунок 1).
Особенности морфологии и эндоскопическая картина
Гиперпластические полипы составляют около 75 % всех зубчатых новообразований, и на них приходится от 28 до 42 % всех полипов толстой кишки. [8] Чаще всего они локализуются в левой половине толстой кишки, преимущественно в дистальных отделах, могут носить множественный характер и не имеют клинических проявлений. [9] Эндоскопически в большинстве случаев представляют собой уплощенные «сидячие» образования (тип 0-IIa по Парижской классификации) размером 0,1–0,5см, редко — 1,0см, с жемчужного цвета поверхностью. [10, 11] Гистологически характеризуются наличием удлинненных недеформированных правильно ориентированных крипт, прямых и трубчатых в нижних отделах и имеющих зубчатые очертания в верхней половине и апикальной части. Зубчатость определяется как на продольных, так и на поперечных срезах, и формируется за счет «наползания» пролиферирующих клеток друг на друга. Зона пролиферации расположена в нижней трети крипт, симметрична и содержит незрелые клетки кишечного эпителия и отдельные нейроэндокринные клетки. [8]
Существует три гистологических варианта гиперпластических полипов: богатый бокаловидными клетками (goblet-cell rich hyperplastic polyp, GCHP), микровезикулярный (microvesicular hyperplastic polyp, MVHP) и бедный муцином (mucin-poor hyperplastic polyp, MPHP) (рис. 1).
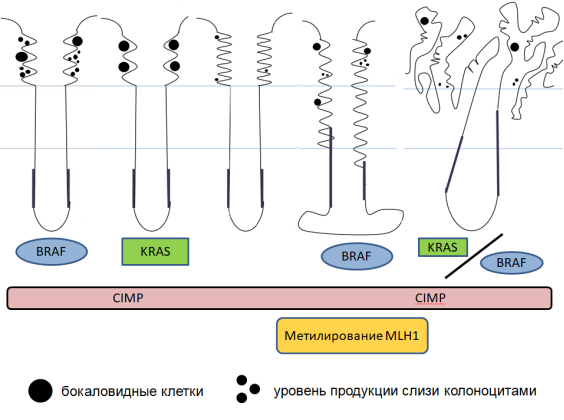
Рис. 1. Фенотипические варианты зубчатых новообразований толстой кишки с отражением гистоархитектоники, уровня слизепродуцирования и основных вариантов генетических аберраций (пояснения в тексте)
Чаще всего встречается MVHP, характеризующийся наличием мелких капель муцина в цитоплазме большинства клеток. GCHP встречается несколько реже и преимущественно построен из клеток с обильной светлой цитоплазмой, заполненной муцинами. Пролиферативная зона и зубчатость выражена сравнительно слабо. [9]
Наиболее редко формируются MPHP, демонстрирующие максимально выраженную зубчатость контура. Этот вариант образований, по предположению ряда авторов, не является самостоятельным, а представляет собой реактивно видоизмененные полипы микровезикулярного типа. [12]
В гиперпластических полипах, как правило, не отмечается признаков клеточной атипии; исключением служат MPHP, в ядрах которых иногда присутствуют изменения, предположительно носящие реактивный характер. [12]
Зубчатые аденомы/полипы на широком основании (sessile serrated adenoma/polyp, SSA/P) составляют около 15–25 % зубчатых образований [8, 9], как правило, располагаются в проксимальных отделах толстой кишки, чаще имеют размеры 0,5–1,0см и более и неполиповидный (приподнято-углубленный 0—IIa + IIc) или комбинированный вид (приподнятый и полиповидный на широком основании 0—IIa + Is); образование «опирается» на складки слизистой оболочки. [4, 10] Не проявляют себя клинически. Характерной особенностью гистоархитектоники является удлиннение и расширение крипт с их деформацией: базальная часть крипт расширяется, приобретает параллельный мышечной пластинке слизистой оболочки ход, что обусловливает характерную L-образную или перевернутую Т-образную форму. Зона пролиферации часто асимметрична, расположена на одной из сторон крипты, смещена в сторону средней трети; это может объяснять патологическое ветвление базальной части крипт, поскольку созревающие клетки смещаются не только к поверхности, но и к нижележащим отделам крипты. [9] Зубчатость ярко выражена, распространена на всем протяжении крипты (рис. 1). [13]
В SSA/P могут отмечаться признаки «обычной» дисплазии (ядра несколько увеличиваются в размерах, становятся удлинненными, гиперхромными, с четко визуализируемыми ядрышками, цитоплазма — более базофильной); однако наряду с ней встречаются фокусы так называемой зубчатой дисплазии (эозинофильных изменений): клетки приобретают кубическую, цилиндрическую форму, ядра становятся пузырьковидными с хорошо различимыми ядрышками, цитоплазма — более эозинофильной. [14]
Окончательные минимальные требования к постановке диагноза на настоящий момент не определены; согласно рекомендациям ВОЗ 2010 года для постановки диагноза необходимо минимум две-три крипты с вышеописанными признаками, тогда как по другим рекомендациям достаточно одной. [8, 9, 12]
Традиционная зубчатая аденома (traditional serrated ademoma, TSA) — наиболее редкий представитель группы зубчатых образований; частота встречаемости — менее 1 % от всех полипов толстой кишки. [8, 9] Чаще встречается в дистальных отделах толстой кишки. В большинстве случаев имеет вид полиповидного образования на ножке (Ip) или на широком основании (Is), также встречаются неполиповидные приподнятые образования (0—IIa). [10]
Редко имеет клинические проявления. Морфологически характеризуется ворсинчатым строением, ворсины отечны, булавовидно расширяются на концах; формируются эктотпированные крипты, отходящие от основной под прямым углом и не достигающие мышечной пластинки. [15] Характерны эозинофильные изменения, но среди эозинофильных клеток могут встречаться типичные бокаловидные (рис. 1). [9] Гистологическая структура, присущая традиционной зубчатой аденоме, может сочетаться с участками, соответствующими по строению гиперпластическому полипу, зубчатой аденоме/полипу на широком основании и «классической» тубулярной аденоме.
В случае, если фрагмент ткани имеет малый объем, забран поверхностно, неправильно ориентирован либо в препарате большое количество артефактов, допустимо заключение «зубчатый полип, неклассифицируемый». [12]
Спорным остается вопрос о наличии взаимосвязи между вариантами зубчатых новообразований: так, считается, что микровезикулярный тип может быть предшественником SSA/P, а GCHP — традиционных зубчатых аденом. [10]
Под зубчатым полипозом понимают наличие в толстой кишке 5 и более зубчатых образований, расположенных проксимальнее сигмовидной ободочной кишки (2 или более из которых размером более 10 мм), либо наличие любого числа зубчатых образований, расположенных проксимальнее сигмовидной ободочной кишки у лиц, чьи родственники первой линии родства страдают зубчатым полипозом, либо наличие 20 и более зубчатых образований любого размера, локализованных в любых отделах толстой кишки. Существует два варианта заболевания: (1) с множеством SSA/P, в том числе и крупных, имеющих тенденцию к проксимальному расположению и (2) с множеством типичных гиперпластических полипов (5 мм и менее), распределенных по всем отделам толстой кишки. Первый вариант более опасен с точки зрения последующей малигнизации. [8]
Специфический путь канцерогенеза
Малигнизация зубчатых образований происходит благодаря реализации механизмов, отличных от таковых при типичном пути формирования колоректального рака «аденома — карцинома». Эти механизмы получили название «зубчатый путь канцерогенеза».
Частота случаев рака толстой кишки, сопряженных с зубчатыми новообразованиями, составляет, по данным различных исследователей, 15–35 % [9, 12, 16, 17]. К настоящему времени посвященные зубчатым образованиям клинические исследования в большинстве своем ретроспективные, что не позволяет достоверно выделить факторы риска развития рака в таких образованиях, а также выработать четкие критерии их малигнизации. [4] Инициирующей мутацией в процессе канцерогенеза является мутация гена BRAF, угнетающая нормальный апоптоз эпителиоцитов толстой кишки. [18] Следующим этапом выступает гиперметилирование CpG-островков, выраженное в высокой или низкой степени (CpG-island methylator phenotype of low/ high grade (CIMP-L/ CIMP-H)). [19, 20, 21] Присоединение метильной группы к цитозину в составе CpG-динуклеотида в позиции С5 цитозинового кольца приводит к сайленсингу гена. [9, 22] Если ген, подвергшийся сайленсингу, относится к группе онкосупрессоров, то угнетение его функции может спровоцировать канцерогенез. Поскольку CpG-островки присутствуют во многих генах (около 60 % всех генов человека), данный механизм задействован в развитии множества опухолей помимо колоректального рака. [3] Гиперметилирование промотора генов «починки» ДНК (mismatch repair, MMR) за счет инактивирующей мутации генов репарации (MLH1 и MLH2) приводит к множественным мутациям и делециям и формированию микросателлитной нестабильности высокой или низкой степени (microsatellite instability of low/ high grade, MSI-L/ MSI-H). Альтернативным, более редким началом пути канцерогенеза, служит мутация гена KRAS, за которой следует формирование хромосомной нестабильности. Хромосомная нестабильность (chromosomal instability, CIN) развивается после инактивирующей мутации гена-супрессора опухоли (APC — adenomatous polyposis coli, аденоматозного полипоза кишечника) в 5 хромосоме с разрывом сигнального механизма Wnt и поражения всех или части хромосом. Это приводит к анэуплоидии, потере гетерозиготности (LOH) и вторичной активации онкогенов, в т. ч. BRAF, либо инактивации супрессорных генов (TP53). [10, 23]
Таким образом, в рамках зубчатого пути канцерогенеза выделяется два генотипа опухолей: первый — с высоким/низким уровнем MSI и высоким уровнем CIMP (CIN-отрицательный), второй — с низким уровнем MSI или ее отсутствием (MSI-L или microsatellite stable (MSS)), низким уровнем CIMP (CIMP-L). На поздних стадиях прогрессии развивается хромосомная нестабильность (CIN-положительный).
Различные гистологические варианты зубчатых образований генетически неравнозначны и являются носителями разных молекулярно-генетических профилей (таблица 1). Это обстоятельство определяет их участие в тех или иных механизмах канцерогенеза. Исследование генетических характеристик представляется чрезвычайно важным, поскольку позволяет судить о злокачественном потенциале каждого из вариантов и, в перспективе, разрабатывать таргетную терапию.
Таблица 1
Молекулярно-генетические характеристики зубчатых образований толстой кишки (ВОЗ, 2010)
|
Вариант зубчатого образования |
Мутация BRAF |
Мутация KRAS |
CIMP |
Метилирование MLH1 |
|
MVHP |
+++ |
- |
+ |
- |
|
GCHP |
- |
+++ |
Недостаточно данных |
- |
|
MPHP |
Недостаточно данных |
|||
|
SSA/P |
+++ |
- |
+++ |
- |
|
SSA/P c клеточной атипией |
+++ |
- |
+++ |
++ |
|
TSA |
+ |
+ |
++ |
- |
|
Зубчатый полипоз |
++ |
+ |
+++ |
+ |
Зубчатые образования представляют собой гетерогенную группу, однако в ней существенно выделяется TSA. Даже несмотря на ограниченные в связи с редкой встречаемостью данные об их молекулярном профиле, выявляется несколько подвариантов этих образований. [24, 25] TSA могут нести как мутацию BRAF, так и мутацию KRAS, а также не иметь ни одной из них. [26] При этом для них нехарактерны гиперметилирование MLH1 или формирование MSI, однако им присуща специфическая мутация — гиперметилирование гена «починки» ДНК MGMT (O6-methylguanine-DNA methyltransferase, метилгуанин-ДНК метилтрансферазы). [27] Этот механизм ассоциирован с развитием колоректальных карцином как с высоким, так и с низким уровнем CIMP. [28]
Ассоциация молекулярных маркеров с гистологическими вариантами зубчатых образований привела к предположению, что существует последовательность: HP → SSA/P → SSA/P с дисплазией → рак. Чаще всего этот каскад наблюдается в проксимальных отделах толстой кишки; есть сведения о повышении частоты мутаций CIMP-высокий, MSI-низкий и BRAF по мере продвижения от прямой кишки к проксимальным отделам. [29]
Кроме того, существуют и основанные на генетическом профиле (мутации KRAS и CIMP) предположения о взаимосвязи некоторых видов гиперпластических полипов с TSA — наличие или отсутствие прекурсоров TSA, тем не менее, остается на настоящий момент спорным вопросом.
Клинические особенности
Несмотря на то, что связь зубчатых образований с колоректальной карциномой доказана, данные об особенностях этого варианта рака обрывочны. Ряд исследований указывает на более стремительное и резкое развитие злокачественных опухолей толстой кишки из зубчатых образований в сравнении с путем «аденома — карцинома», а также на агрессивность их поведения: так, TSA часто прогрессируют в зубчатые карциномы муцинозного или трабекулярного типа. [10] В других исследованиях отмечают, что потенциал озлокачествления зубчатых аденом ниже, чем обычных аденом, однако крупные образования с локализацией в проксимальных отделах толстой кишки могут быстро трансформироваться в зубчатую карциному. [30] Известно, что карциномы толстой кишки с мутацией BRAF имеют худший прогноз, чем KRAS-мутантные, а колоректальные карциномы, развившиеся по зубчатому пути, требуют особого режима химиотерапии [31, 32]
Хотя проспективных клинических исследований не имеется, однако с точки зрения генетики опухоли, фенотип CIMP+MSI сопровождается быстрым прогрессированием карциномы. [10]
Вывод
Зубчатые образования являются значимыми прекурсорами колоректального рака. Несмотря на это, в настоящее время отсутствуют общепринятые стандарты их диагностики, что затрудняет постановку диагноза, а также выработку тактики ведения пациентов и таргетной терапии новообразований этой группы. Классификация, основанная на морфологических критериях, недостаточно точна и не позволяет корректно оценить потенциал малигнизации, в связи с чем требует дополнений и пересмотра с позиций молекулярно-генетического профиля образований, однако для его точного определения требуется проведение крупных исследований. Также целесообразна разработка панели биомаркеров, способных без проведения генетического исследования достоверно указать на принадлежность образования к той или иной классификационной единице.
Литература:
- Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) / под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. Москва: МНИОИ им. П. А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. 250 с.
- Патологоанатомическая диагностика опухолей человека: в 2 т. / под ред. Н. А. Краевского, А. В. Смольянникова, Д. С. Саркисова. — 4-е изд., испр. и доп. — Москва: Медицина, 1993. Т. 1. — 560 с.
- O’Brien M. J. The adenoma–carcinoma sequence in colorectal neoplasia / M. J. O’Brien, D. Gibbons // Surg. Oncol. Clin. N. Am. — 1996. — № 5. — P. 513–22.
- Веселов В. В. Зубчатые образования толстой кишки / В. В. Веселов // Доказательная гастроэнтерология. — 2016. — № 4. — С. 27–35.
- Urbanski S. J. Mixed hyperplastic adenomatous polyps — an underdiagnosed entity. Report of a case of adenocarcinoma arising within a mixed hyperplastic adenomatous polyp / S. J.Urbanski, A. E. Kossakowska, N. Marcon, W. R. Bruce // Am. J. Surg. Pathol. — 1984. –Vol. 8, № 7. — P. 551–6.
- Longacre T. A. Mixed hyperplastic adenomatous polyps/serrated adenomas: a distinct form of colorectal neoplasia / T. A. Longacre, C. M. Fenoglio-Preiser // Am. J. Surg. Pathol. — 1990. –№ 14. — Р. 524–37.
- Goldstein N. S. Hyperplasticlike polyps that preceded microsatellite-unstable adenocarcinomas / N. S. Goldstein [et al.] // Am. J. Clin. Pathol. 2003. № 119. Р. 778–796.
- WHO Classification of Tumours of the Digestive System, 4th Edition / Fred T. Bosman, Fatima Carneiro, Ralph H. Hruban et al. — IARC: Lyon, 2010. — 417 p.
- Bettington M. L. A clinicopathological and molecular analysis of 200 traditional serrated adenomas / M. L. Bettington [et al.] // Mod. Pathol. — 2015. — № 28. –P. 414–427.
- Никишаев В. И. Эндоскопическая диагностика раннего колоректального рака / В. И. Никишаев, А. Р. Патий. И. Н. Тумак, И. А. Коляда // Український журнал малоінвазивної та ендоскопічної хірургії. 2012. Vol. 16, № 1. Р. 35–55.
- The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002 / Gastrointest. Endosc. — 2003. — № 58 (6, Suppl.). –Р. 3–43.
- Rex D. K. Serrated lesions of the colorectum: rewiew and recommendations from an expert panel / D. K. Rex [et al.] // Am. J. Gastroenterol. — 2012. — Vol. 107 № 9. Р. 1315–30.
- Gurudu S. R. et al. Sessile serrated adenomas: demographic, endoscopic and pathological characteristics / S. R. Gurudu [et al.] // World J. Gastroenterol.
- 2010. Vol. 16. № 27. P. 3402–5.
- Харлова О. А. Зубчатые образования толстой кишки / О. А. Харлова, Н. В. Данилова, П. Г. Мальков и др. // Архив патологии. — 2015. — № 1. — С. 60–68.
- Berkeley N. The cutting edge of serrated polyps: a practical guide to approaching and managing serrated colon polyps / N. Berkeley [et al.] // Gastrointest. Endosc. — 2013. — Vol. 77, № 3. — P. 360–75.
- Kedrin D. Genetics of the serrated pathway to colorectal cancer / D. Kedrin, M. K. Gala // Clinical and Translational Gastroenterology. — 2015. — Vol. 6, № 4. — Р. 84.
- Bettington M. L. The serrated pathway to colorectal carcinoma: current concepts and challenges / M. L. Bettington [et al.] // Histopathology. — 2013. — № 62. — Р. 367–386.
- Yang H. M. Molecular and histologic considerations in the assessment of serrated polyps /H. M. Yang [et al.] // Arch. Pathol. Lab. Med. — 2015. — Vol. 139, № 6. — P. 730–41.
- Bond C. E. p53 mutation is common in microsatellite stable, BRAF mutant
- colorectal cancers / C. E. Bond [et al.] // Int. J. Cancer. — 2012. — № 130. –P. 1567–1576.
- Hafezi-Bakhtiari S. Tubulovillous/villous adenomas and traditional serrated adenomas in the left colon and rectum show histological overlap / S. Hafezi-Bakhtiari [et al.] // Mod. Pathol. 2014. № 27. Р.161–212.
- Kim M. J. Pedunculated serrated polyp with histologic features of sessile serrated adenoma: a clinicopathologic and molecular study / M. J. Kim [et al.] // Am. J. Surg. Pathol. — 2013. — № 37. — P. 1039–1043.
- Kohli R. M. TET enzymes, TDG and the dynamics of DNA demethylation / R. M. Kohli, Y. Zhang // Nature. — 2013. — Vol. 502, № 7472. — P. 472–479.
- Stefanius K. Frequent mutations of KRAS in addition to BRAF in colorectal serrated adenocarcinoma / K. Stefanius [et al.] // Histopathology. — 2011. — № 58. — P. 679–692.
- Leggett B. Role of the serrated pathway in colorectal cancer pathogenesis / B. Leggett, V. Whitehall // Gastroenterology. — 2010. — Vol. 138, № 6. — P. 2088–100.
- Ngo N. T. Differential expression of p53 and p504s in hyperplastic polyp, sessile serrated adenoma and traditional serrated adenoma / N. T. Ngo [et al.] // Int. J. Colorectal Dis. — 2010. — Vol. 25, № 10. — P. 1193–200.
- Fu B. Clinicopathologic and genetic characterization of traditional
- serrated adenomas of the colon / B. Fu [et al.] // Am. J. Clin. Pathol. — 2012. — Vol. 138, № 3. –P. 356–366.
- Whitehall V. L. Methylation of O-6-methylguanine DNA methyltransferase characterizes a subset of colorectal cancer with low-level DNA microsatellite instability / V. L. Whitehall [et al.] // Cancer Res. –2001. — Vol. 61, № 3. –P. 827–30.
- Ogino S. Molecular correlates with MGMT promoter methylation and silencing support CpG island methylator phenotype-low (CIMP-low) in colorectal cancer / S. Orgino [et al.] // Gut. — 2007. — Vol. 56, № 11. — P. 1564–71.
- Yamauchi M. Assessment of colorectal cancer molecular features along bowel subsites challenges the conception of distinct dichotomy of proximal vs. distal colorectum / M. Yamauchi [et al.] // Gut. — 2012. — № 61. — P. 847–854.
- Wang L. P. et al. Serrated lesions of colon and their malignant potential / L. P. Wang [et al.] // Zhonghua Bing Li Xue Za Zhi. — 2010. — Vol. 39, № 7. — P. 447–51.
- Conesa-Zamora P. Expression profiling shows differential molecular pathways and provides potential new diagnostic biomarkers for colorectal serrated adenocarcinoma / P. Conesa-Zamora [et al.] // Int. J. Cancer. — 2013. –Vol. 132, № 2. — P. 297–307.
- Joyce T. A molecular signature for oncogenic BRAF in human colon cancer cells is revealed by microarray analysis / T. Joyce [et al.] // Current Cancer Drug Targets. 2012. Vol. 12, № 7. P.873–898.







