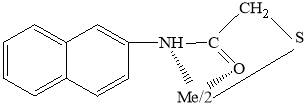
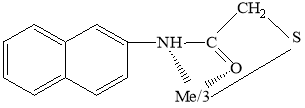
Показана возможность титрования некоторых благородных металлов и ртути. Установлено, что при образовании комплексов тионалид и тиомочевины с исследованными нами металл в конечной точке титрования их молярное соотношение с реагентами 1:1 для Ag+, 1:2 Pd2+ и Hg2+.
Ключевые слова: амперометрическое титрование, ртути, серебра, палладий, тиомочевина, тионалид, электрод, окисление, восстановление, комплексообразование, точка эквивалентности, конечная точка титрования
Преимущество амперометрического титрования [1, c. 232] состоит в том, что его можно проводить в отсутствие комплексообразующих индикаторов, что положительно сказывается на селективности метода и создает возможность для проведения во многих случаях последовательных титрований. Кроме того, метод чувствителен и допускает титрование весьма малых количеств и даже очень низких концентраций исследованных ионов металлов. Известны сообщения [2, c. 326, 3, c. 18] об успешном и поразительно точном определении ионов различных металлов в растворах с их концентрацией до 10–7 М. Во многих случаях можно применять отделение мешающих компонентов путем их осаждения, так как осадки чаще всего, как правило, не мешают определению.
Настоящая работа посвящена изучению взаимодействия β-амино-нафталида тиогликолевой кислоты (тионалида) (ТНЛ) и тиомочевины (ТМЧ) с солями некоторых платиновых металлов и ртути(II) с целью их применения для определение исследуемых металлов количественного определение.
Экспериментальная часть
Приготовление исходного раствора Pd(II).Растворяли навеску 0,266 г Pd растворяли в смеси 0,1 М НСl и HNO3 (3:1), доводили до объема 250 мл. Приготовление исходного 0,05 М раствора Hg(II). Навеску 4,5111 г Hg(NO3)2 ∙2H2O растворяли в 5–10 мл 1,0 М HNO3 (для предотвращения гидролиза) и доводили до объема в 250 мл.
Приготовление исходного 0,01 М раствора Ag(I). Навеску 0,425 г АgNO3 растворяли в 5–10 мл 1,0 М HNO3 и доводили объем до 250 мл.
Универсальные буферные смеси готовили смешиванием 0,04 М растворов H3PO4, CH3COOH и H3BO3 с 0,2 М NaOH различного объема [4, c. 126].
Для приготовления 0,03 М раствора ТНЛ брали его навеску 1,629 г и растворяли в 98 % уксусной кислоте, затем ею же доводили общий объем до 250 мл. 0,1 М раствор ТМЧ готовили растворением навески свежеперекристаллизованного препарата (1,829 г) в воде или в 96 % — ном этиловом спирте. Установлено, что 0,005–0,1 М растворы ТНЛ и ТМЧ практически не изменяют своего титра (при условии их хранения в темноте и на холоде) в течение 20–25 сут. [4].
Использованы: иономер универсальный ЭВ-74 и рН-метр рН/мV/ТЕМР Meter P 25 EcoMet (Ю. Корея).
Реактивы имели квалификации «ос.ч»., «х.ч». и «ч.д.а.».
Результаты иих обсуждение
Ограничением амперометрического титрования, как и других объемных методов определения различных компонентов, является нестехиометричная реакция, протекающая между титруемым металлом и реагентом.
Определение палладия(II), серебра(I), и ртути(II) в промышленных материалах и природных объектах актуальная задача электроаналитической химии. Поэтому, необходимо было показать возможность и оптимизировать условия титрования исследованных металлов растворами ТНЛ и ТМЧ в широких диапазонах их концентраций и при соответствующем подборе условий их определения. При определении микро- и следовых концентраций исследованных благородных металлов и ртути растворами ТНЛ и ТМЧ получаются различные по форме и характеру кривые амперометрического титрования, где КТТ при молярном соотношении компонентов реакции комплексообразования равно 1:1 для Ag(I), 1:2 Pd(II) и Hg(II). Из литературных данных [5, c. 342] можно заключить, что действие реагентов с общей формулой R-SH можно сравнить с таковым сероводорода. Установлено, что вещества, содержащие сульфгидрильную группу, способны реагировать только с элементами, образующими сульфиды в водной среде. Металлы, сульфиды которых нацело гидролизуются водой (Al, Mg и др.), не дающие в присутствии воды устойчивую связь Me–S, не реагируют и с органическими реагентами, содержащими SH– группу. Элементы, образующие труднорастворимые сульфиды, способны давать с ТНЛ устойчивые соединения, относящиеся к классу внутренних комплексных соединений.
Присоединение RS-группы происходит путем насыщения главной валентности металла-комплексообразователя, побочная валентность которого, насыщается за счет кислорода карбоксильной и азота аминной групп и при этом образуется прочный пятичленный цикл.
Литературные данные [6, c. 110] подтверждают образование платиной, палладием и некоторыми другими элементами прочных комплексов с ТНЛ. Выявлены условия комплексообразования в зависимости от температуры исследуемого раствора. Установлено, что комплекс платины с этим реагентом устойчив даже до температуры 170 °С, а тионалидное соединение палладия не разлагается даже при нагревании до 195 °С; но при более высокой температуре органическая часть этих соединений разрушается. Полученные данные показывают, что комплекс платины с ТНЛ представляет собой соединение, отвечающее общей структурной формуле комплексов ряда металлов с этим реагентом:
|
|
|
|
Для двухвалентных металлов |
Для трехвалентных металлов |
Установлено, что при титровании исследуемых металлов растворами ТНЛ и ТМЧ образуются высокоустойчивые комплексы, в строгом соответствии с теоретическими предпосылками, при этом, кривые титрования в т. э. имеют резкие изломы.
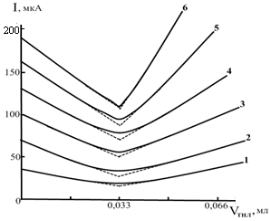
Рис 1. Влияние различных по природе фоновых электролитов и буферных смесей на форму кривых титрования Hg(II) раствором ТНЛ:
1–Щавелевая кислота (рН 2,20);
2–Калий виннокислый (рН 1,68);
3–Аминоуксусная кислота (рН 1,50);
4–Калий цитрат (рН 1,69);
5–Калий фталевокислый (рН 1,58);
6–Универсальный буфер Бриттона– Робинсона (рН 2,62)
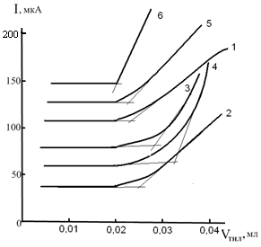
Рис 2. Влияние различных по природе фоновых электролитов и буферных смесей на форму кривых титрования Au(III) раствором ТНЛ:
1–Щавелевая кислота (рН 2,20);
2–Калий виннокислый (рН 1,68);
3–Аминоуксусная кислота (рН 1,50);
4–Калий цитрат (рН 1,69);
5–Калий фталевокислый (рН 1,58);
6–Универсальный буфер Бриттона– Робинсона (рН 2,62)
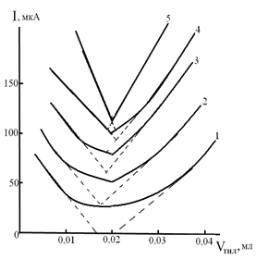
Рис 3. Влияние различных по природе фоновых электролитов и буферных смесей на форму кривых титрования Pd(II) раствором ТНЛ:
1–Щавелевая кислота (рН 2,20);
2–Калий виннокислый (рН 1,68);
3–Калий цитрат (рН 1,69);
4–Калий фталевокислый (рН 1,58);
5–Универсальный буфер Бриттона– Робинсона (рН 2,62)
Эксперименты показали, что из всех исследованных фоновых электролитов и буферных смесей наилучшие кривые титрования наблюдаются для Hg(II), Au(III) и Pd(II) раствором ТНЛ на универсальном буфере Бриттона-Робинсона (рН 2,62), а при определении Ag(I) и Pd(II), раствором ТМЧ наилучшие по форме кривые получаются на фоне 0,2 М HCl для Ag(I) и 1,0 М H2SO4.
Как правило, концентрация титрующего реагента на несколько порядков должна превышать содержание определяемых металлов. Поэтому титрант прибавляли небольшими порциями прецизионной поршневой микробюреткой, благодаря чему разбавлением исследуемого раствора можно пренебречь.
Титрование палладия(II), серебра(I) и ртути(II) растворами ТМЧ (0,1 М) и ТНЛ (0,03 М) проводили с помощью универсального буфера Бриттона-Робинсона с рН среды в диапазоне от 1,81 до 12,50, щавелевой кислоты (рН 2,20), калия виннокислого (рН 1,68), аминоуксусной кислоты (рН 1,50), цитрата калия (рН 1,69), фталевокислого калия (рН 1,58) и в присутствии фоновых электролитов: HCl, HClO4, H2SO4, HNO3, KCl, NaCl и др. при разности потенциалов на электроде (∆Е) в диапазоне 0,25–1,25 В. Установлено, что титрование протекает достаточно быстро, приводя к хорошо воспроизводимым и правильным результатам определения, а также точным расходам титранта в КТТ.
При титровании получаются достаточно четкие кривые титрования теоретически ожидаемой классической нисходящей левой и восходящей правой ветвями с относительно небольшим участком кривой плавного искривления между ними. При титровании исследованных благородных металлов и ртути осадка почти не образуется, оттитрованные растворы остаются сравнительно прозрачными, продукты реакции при комплексообразовании слабо окрашены в желтоватый цвет.
Характер изменения величины предельного анодного тока по мере прибавления ТНЛ и ТМЧ к титруемому раствору определяется сначала нисходящей левой, а затем восходящей правой ветвями кривой, из которой видно, что первая добавленная порция реагентов затрачивается на их взаимодействие с ионами золота(III), палладия(II), серебра(I), платины(IV), ртути(II) и поэтому величина предельного тока окисления титрантов понижается вследствие их связывания с ионами определяемых металлов. После достижения т. э. и полного связывания ионов металлов в комплексы избыток ТНЛ и ТМЧ дает растущий анодный ток, свидетельствующий об окончании титрования.
Все выявленные факты свидетельствуют о том, что при взаимодействии ионов определяемых металлов с ТНЛ и ТМЧ образуются достаточно хорошо растворимые комплексы, отвечающие формулам: для ТНЛ [Рd(С12Hl0ONS)2], [Hg(С12Hl0ONS)2], [Au(C12H10ONS)3] и для ТМЧ [Рd(NH2–CS–NH2)2], [Ag(CSN2H4)]+, соответствующие теоретически ожидаемым.
Литература:
- Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. // М.; Мир. 1975. С. 531.
- Золотов Ю. А. Основы аналитической химии. // В 2-х т. М.; Высш. шк. 2004. Т.2. 504 с.
- Сонгина О. А., Захаров В. А. Амперометрическое титрование. // М.; Химия. 1979. 204 с.
- Лурье Ю. Ю. Справочник по аналитической химии. // М.; Химия.1989. 448 с.
- Оаэ С. Химия органических соединений серы. // М.: Химия, 1975. 512 с.
- Гинзбург С. И., Езерская Н. А., Прокофьева И. В. и др. Аналитическая химия платиновых металлов. // М.; Наука. 1972. 616 c.