Во все времена цвета имели символическое значение. В настоящее время это и сейчас выражается в цветах гербов, национальных флагов и не только. В древности люди также заботились и о том, чтобы их одежда и предметы домашнего обихода были окрашены в красивые цвета. При религиозно-культовых обрядах, напротив, использовались устраняющие отталкивающие расцветки. В 50-х годах 19-го столетия органическая химия начала свое триумфальное шествие и одной из важных задач, стоявших перед нею, являлось получение природных красителей синтетическим путем. [1]
Синтезированы 5 различных производных азофенолов на основе реакции диазотирования, также изучены химические свойства процессов галогенирования, алкилирования, а также реакции между пропаргиловым эфиром и изоцианатами.
Из истории известно, что первые попытки связать химическое строение красителей были сделаны американским химиком Гербертом Чарлз Брауном. Опытным путем он установил, что атомы хлора, брома, сульфо- и карбоксильная группы замедляют выцветание, последняя в особенности. Имеет значение также и положение заместителя.
Наличие в молекуле красителя первичных аминогрупп обусловливает низкую светопрочность, а ацилирование (в особенности хлорированными красителями) повышает светопрочность. [2]. При галогенировании атака ароматического субстрата может осуществляться различными электрофилами.
Свободные галогены CI2 и Br2 могут легко атаковать активированное ароматическое ядро, для поляризации атакующей молекулы галогена необходимы катализаторы типа кислот Льюиса, такие как AICI3, с помощью которых в молекуле галогена появляется так называемый «электрофильный конец». Энергия, требующаяся для образования катиона CI+, очень велика [3]. Электронодонорные заместители в ароматическом кольце (-N=N-) ускоряют процесс и направляют галоген в орто- и пара-положение:
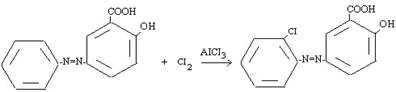
Азосоединения, вероятно, образуют π-комплекс, например, с Br2, с которым затем взаимодействует кислота Льюиса. При бромировании в случае использования FeBr3 и других малоактивных кислот Льюиса, образование катиона галогена идет в незначительной степени, а основной атакующей частицей является поляризованный комплекс, например:
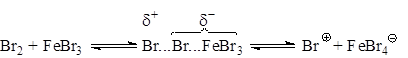
Катализатор, вероятно поляризует связь Br-Br, способствуя образованию σ-связи между теперь уже электрофильным концом молекулы брома и атомом углерода кольца:
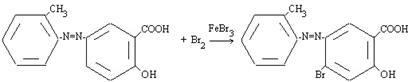
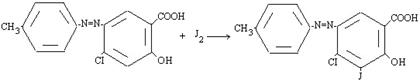
Изучены химические превращения производных азофенола: реакция йодирования протекает по механизму SE.
В гетеролитических реакциях замещение нуклеофильных частиц часто предоставляет свою электронную пару для образования новой связи – не сразу, а по стадиям, то есть реализуется механизм замещения с переносом электрона и образованием промежуточных анион-радикальных частиц.
Гомолитический путь замещения у насыщенного атома углерода осуществляется в основе по цепному радикальному механизму и характеризуется стадиями инициирования, роста и обрыва цепи [4]. К важнейшим реакциям этого типа относится гомолитическое бромирование.
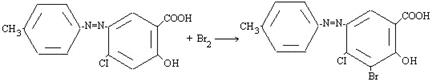
Нуклеофильное замещение реакции зависимости от кинетических закономерностей разделяются на би- и мономолекулярные. Биомолекулярное замещение SN2 осуществляется через переходное состояние, в котором происходит одновременное образование новой и разрыв старой связи.
Нам ясно, что изоцианаты являются высоко реакционноспособными соединениями. Они легко реагируют с соединениями, содержащими подвижные атомы водорода, например, аминами и спиртами. Этот процесс широко используют в лакокрасочных составах для отверждения гидроксилсодержащих пленкообразователей. Взаимодействие изоцианатов с ОН-группами пленкообразователей протекает с достаточной скоростью уже при комнатной температуре. Этот процесс можно ускорить за счет введения катализаторов или повышения температуры. Скорость реакции зависит также от вида применяемого изоцианата [5].
Для отверждения гидроксилсодержащих пленкообразователей используют, как правило, бифункциональные изоцианаты или полиизоцианаты. Наиболее широко в промышленности применяют гексаметилендиизоцианат.
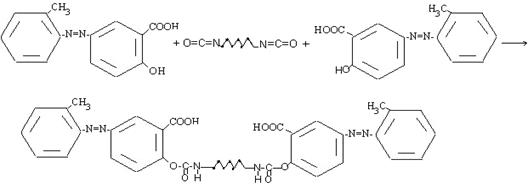
Взаимодействием гексаметилендиизоцианата с 2-метилфенил-азо-4-гидроксифенил-карбокси-3-ом образуется N,N′-гексаметилен бис [(2-метилфенил-азо-4-гидроксифенил-карбокси-3-ило)-карбамат], представляющий собой окрашенный высокоплавный порошок, труднорастворимый в воде и других доступных органических растворителях.
Свойства полиуретановых покрытий зависят от равномерности и плотности мостиковых связей, определяющих их химстойкость, твердость и механическую прочность, а также от числа образованных уретановыми группами водородных мостиков, которые придают покрытию эластичность.
Наука утверждает, что гидроксиазоарены является ОН-кислотами. При их ионизации углубляется окраска, особенно в случаях о- и п-изомеров, где имеется прямое сопряжение с азогруппой [6]. Углубление окраски объясняется увеличением электронодонорных свойств заместителя при переходе от –ОН к –О-
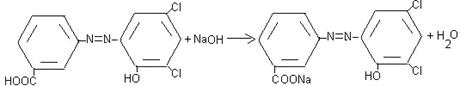
При действии разбавленных щелочей на водные растворы красителя выделяются свободные основания, которые хорошо растворяются в некоторых растворителях (бензиловый спирт, феноксиэтанол) и используются в производстве чернильных паст.
При изучении взаимодействия натриевой соли и красителя при действии галогеналкана были синтезированы ароматические сложные эфиры. Реакция протекает по типу электрофильного замещения.
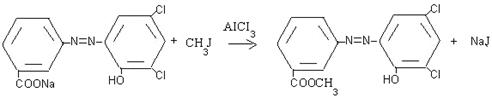
Обратимость реакции алкилирования по Фриделю-Крафтсу приводит к тому, что в системе одновременно идут все возможные реакции алкилирования и деалкилирования, причем затрагивается и мета-положение, так как алкильная группа активирует все положения бензольного кольца, хотя и в разной степени.
Для получения соединения с биологически активными и красящими свойствами нами были синтезированы пропаргиловые эфиры замещенных азо-гидроксибензолов. Эфиры получены взаимодействием замещенных азо-гидроксибензолов с хлористым или бромистым пропаргилом в присутствии поташа в среде ацетона при кипячении в течение 5–6 часов, по следующей схеме:
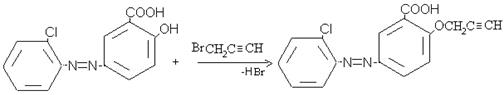
Полученные пропаргиловые эфиры представляют собой вещества желтого цвета, со своеобразным специфическим запахом, хорошо растворимы в эфире, ацетоне, бензоле, этаноле, плохо растворимы в воде. Чистоту пропаргиловых эфиров контролировали ТСХ на незакрепленном слое AI2O3 II степени активности в системе бензол, бензол:этанол (10:1), бензол:гексан (10:1).
Для установления некоторых закономерностей реакции конденсации пропаргиловых эфиров замещенных азо-гидроксибензолов, нами изучены влияние температуры и продолжительность реакции на протекание реакции. Установлено, что образование новых веществ протекает за сравнительно короткий срок, около 6 часов, и при этом выход целевого продукта составляет 60–70 %.
Полученные эфиры благодаря наличию в их молекуле фрагментов азо-гидроксибензола и пропаргильной группы проявляют антимикробные, противовоспалительные и красящие свойства.
Литература:
1. Бурятский Государственный Университет. Курсовая работа по органической химии «Получение синтетических красителей реакцией азосочетания на примере синтеза 3-окси-4-карбоксиазобензола» стр. Улан-Уде, 2003г
2. Чекалин М. А., Пасет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, 2изд., Л., 1980.
3. Merkle K., Schiifer H., Pigment handbook, ed. By T. Patton, v. 3, 1973, p. 157–67.
4. Басодо Ф., Пирсон Р. Механизмы неорганических реакций, пер. с англ. М., 1971, с. 28–32.
5. Б.Мюллер, У. Пот. Журнал «Лакокрасочные материалы и покрытия. Принципы составления рецептур». № 10, стр.20–25, 2006г
6. Нейланд. «Органическая химия» стр.434, Л., 1969г

